2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing, 100049, China
在众多能源类型中, 太阳能以其清洁无污染、取之不尽用之不竭等优点成为最具应用潜力的可再生能源之一.太阳能够稳定地辐射出大量的能量(1.2×1034 J/year), 大约一半的能量(3.0×1024 J/year)可以穿透大气到达海洋和陆地表面, 而自然界中的光合作用仅固定了地球上约0.1%的太阳能, 人类在世界上的能源消耗(4.0×1020 J/year)约占太阳能的0.01%.所有化石资源中积累的能源总量只相当于地球七天内接收到的太阳能[1].但是目前太阳能多以热能的形式被人类直接利用, 要想将其储存并转化为可用的能源, 需要通过一定途径, 比如将其转化为氢能、电能、化学能等易于存储的能源类型.
目前, 大多数可利用的材料仅仅对太阳光谱中的紫外和可见区的光有响应, 而要利用较长波长的光, 就必须发展出对太阳光谱中较长波长的敏感的材料.近年来发展出的上转换材料就具有这样的特征.一般认为, 材料只能受到高能量的光激发, 发射出低能量的光, 即经短波长、高频率的光激发, 材料发射出长波长、低频率的光.而上转化发光则与之相反, 指的是材料受到低能量、长波长的光激发, 发射出高能量、短波长的光, 被称为反-斯托克斯发光, 而能实现这一目标的材料被称之为上转换发光材料.与传统典型的发光过程中只涉及一个基态激发态不同, 上转换过程需要许多中间态来累积低频的激发光子的能量[2].通过此过程而实现的上转换发光材料主要分为四大类:其一是基于稀土离子掺杂的透明无机主体材料, 其上转换发光现象是通过长寿命的稀土离子中间激发态顺序吸收光子或在激发态之间进行敏化的能量转移来实现[3-5]; 其二, 是基于三重态-三重态湮灭(TTA: triplet-triplet annihilation)上转换发光体系, 其中敏化剂吸收的光子能量通过三重态-三重态能量转移(TTET)转移至受体, 受体经历TTA, 产生上转换的单线态荧光[6].其三, 是表面等离子体共振上转换材料, 通过金属离子表面等离子体共振热载流子注入的方式实现能量上转换[7].其四, 是半导体纳米颗粒上转换材料, 其中包括半导体纳米颗粒、金属半导体量子点、以及碳量子点.我们将对近年来碳量子点发光材料的研究进行总结, 并讨论碳量子点在能源、环境和其他一些领域的应用.
1 碳量子点上转换发光体系碳量子点(CQD)具有化学惰性, 生物相容性和低毒性等优势, 可能在能源、生物医药等领域得到广泛的应用. CQD可通过表面被聚合物(例如PEG)钝化[8]而表现出很强的光致发光特性.在生物成像, 疾病检测和药物输送中使用表面钝化后的功能化生物分子更为有效.并且, 碳材料由于其优异的电化学性能还展现出在催化、电子器件等许多领域广泛的应用前景.碳量子点, 作为碳材料的一种, 尺寸量子化后还具有特殊性能[9].
碳量子点于2004年首次由Xu等[10]报道(图 1a), 他们在利用电弧放电制备了单壁碳纳米管(SWCNTs), 并在电泳法纯化产物的过程中首次发现了可以释放出明亮荧光的组分(后被证实为碳量子点). Sun及其同事[11]在水蒸气存在条件下使用氩气作为载气, 通过激光销蚀碳材料的方法合成了大小不同的的纳米级碳粒子聚集体, 并提出了碳量子点的概念.通过对样品进行酸氧化和PEG表面钝化处理后, 可观察到明亮的荧光.自此之后, 对碳量子的研究得到了越来越多的关注(图 1b).
2 碳量子点发光特性CQD通常是准球形或片状的纳米颗粒, 包含有无定形的纳米晶核, 它们主要是石墨或涡轮复层碳(sp2碳)或石墨烯, 通过类金刚石sp3杂化碳插入物融合而形成的氧化石墨烯片(图 2)[12-13]. CQD表面有许多羧基部分, 这些羧基部分使其展现出出色的水溶性和适合的化学反应性, 可用于进一步官能化, 并与各种有机聚合物、无机或生物材料形成表面钝化基团.表面官能化不仅能够调控其在水性和非水性溶剂中的溶解度, 而且可使其荧光特性得到增强[14].碳量子点同时具有下转换与上转换发光的性能, 相应发光机理如下.
2.1 下转换光致荧光发光(PL)所有碳量子点都具有相似的大小和化学基团, 但是根据选择的碳源不同、合成方法不同, 会使其具有不同程度的表面缺陷态与溶解性.碳量子点的一个特性是具有光致发光特性, 在UV区域(230~280 nm)显示出非常宽的吸收带, 其尾部可延伸至可见光范围, 并且能够发射出蓝绿、黄或橙色荧光[15].碳量子点荧光发光机制分为两种, 其一是以GO/RGO为碳源的GQD, 其二是其他碳源合成的CQD.
GQD的下转换荧光发光机制被认为是由表面/边缘状态的共轭π域引起的[16-17]. Lin等[16]通过剥落和分解石墨薄片制备了大约20 nm具有明显的单层和清晰锯齿形边缘的GQD, 在锯齿形边缘的三碳烯中产生了一个新打开的带隙, 对应于三碳烯中从最高占据分子轨道(HOMO)到σ, 到最低空分子轨道(LUMO)到π轨道的过渡.这种PL机理是由之字形边缘的三重卡宾态决定的, 而不是由量子限制效应决定的(图 3a). Xu等[17]也使用单粒子光谱测量来研究了GQD的PL行为, 如图 3b所示, 他们认为是通过π-π*跃迁的光激发电子弛豫为sp2能级或缺陷态, 从而产生蓝色PL.由于sp2碳域内电子的量子限制效应, 蓝色发射可能具有离散的特征.长波长发射与含氧官能团(在边缘和/或在基面上)和石墨烯核的杂化结构有关.尽管颗粒之间的大小和层数存在明显差异, 但所有研究的GQD都具有几乎相同的光谱线形状和峰位置, 表明这些GQD的PL是由其表面状态引起的.

|
图 3 GQD中的表面/边缘状态[16-17] Fig.3 Surface/edge states in GQD (a) Free zigzag emission mechanism of the GQDs; (b) Energy level structures to explain the optical behaviors of photoexcited electrons in GQDs[16-17] |
另外, 对于CQD, 通常认为是在紫外光的激发下, 电子由HUMO跃迁至LUMO的过程实现的.相关研究也表明碳量子点的这种PL特性随尺寸的不同会发生变化. Li等[18]通过理论计算得出碳量子点HOMO-LUMO能隙对CQD片段大小具有依赖性(见图 4), 随着片段大小的增加, 能隙逐渐减小, 而不同尺寸的CQD具有不同的发光性能, 发射光谱随着尺寸的变小而发生蓝移.由此发现CQD的PL特性来自量子尺寸的材料结构本身, 而不是碳氧表面.并且通过表面钝化降低了表面缺陷态而引起的电子辐射复合, 可以有效提高量子产率.

|
图 4 CQD的PL图谱及尺寸带隙依赖性[18] Fig.4 PL pattern of CQD and the relationship between size and band gap[18] a) CQDs optical images illuminated under white (left; daylight lamp) and UV light (right; 365 nm); b) PL spectra of CQDs; c) relationship between the CQDs size and the PL properties; d) HOMO-LUMO gap dependence on the size of the graphitene fragments |
碳量子点另一吸引人的性质是具有上转换发光的能力.但是通过已有的实验研究并没有得出普适的上转换发光机理, 目前讨论最多的机理有两种, 一是多光子激发上转换, 二是反斯托克斯光致发光(ASPL), 具体碳量子点的上转换发光机制是通过观察发光强度对激发光源激光功率的依赖性推演出的.
2.3 多光子激发上转换Cao等[19]利用激光销蚀的方法, 将聚(丙酰亚乙基亚胺-共亚乙基亚胺)(PPEI-EI)作为表面钝化剂, 合成了尺寸小于5 nm的碳量子点.并通过使用配备有氩离子激光器和飞秒脉冲Ti:蓝宝石激光器的Leica共焦荧光显微镜, 观察到发光强度对激发激光功率的依赖性, 证实了脉冲红外激光激发的本质上为双光子过程.用共焦显微镜上的外部检测器收集发光信号, 并通过使用焦平面中的精密功率计来确定了用于激发的激光功率.如图 5a所示, 激光功率与发光强度之间具有明显的二次关系, 由此证实了用两个近红外光子激发确实是观察到了碳量子点上转换发光. 图 5b是另外一个认为碳量子点上转换发光的过程是通过多光子激发实现的, 碳量子点在与二氧化钛复合后实现了可见光照射下降解罗丹明B[20].
2.4 反斯托克斯光致发光(ASPL)Shen等[21]通过水合肼快速还原聚乙二醇表面钝化氧化石墨烯的方法, 合成了具有上转换发光性能的石墨烯量子点(GQD).他们推测是由于反斯托克斯光致发光(ASPL)而引起的上转换发光, 其中π和σ轨道之间的能隙接近1.1 eV.如图 6a所示, 当激发波长从600变为800 nm时, 上转换发射峰从390变为468 nm.值得注意的是, 上转换发射光(Em)和激发光(Ex)的能量转换几乎没有变化, 约为1.1 eV.插图显示了Em和Ex之间的线性关系, 拟合线的函数为Em = 1.00Ex + δE(R2 = 0.9983), δE = 1.1 eV.并通过建立GQD的能级结构模型进一步确认和解释了这些变化如何来自不同尺寸大小的GQD. 图 6b表示出了GQD的各种典型的电子跃迁过程的示意图.如图 6b (a)和(b)所示, PL光谱同样是从LUMO到HOMO的激发跃迁. UCPL可以看作是反斯托克斯跃迁.卡宾基态的多重性与p和s轨道之间的能量差(δE)有关, 霍夫曼确定δE应该低于1.5 eV.在此研究工作中, 上转换过程中激发光和发射光之间的能量接近1.1 eV.很多学者指出, CQD的UCPL性质应归因于多光子的活化过程, 但此工作推测更符合ASPL过程.当大量低能光子激发p轨道电子时, p电子将转变为高能态(例如LUMO), 然后电子转变回低能态.此过程中, 当电子跃迁回σ轨道时, 发射出上转换的PL.这也解释了为什么上转换激发光和发射光之间具有恒定的能量差.
2.5 上转换发光是否真实存在碳量子点是否具有上转换发光性能成为一个争议的科学问题.比如Wen等[22]就认为某些明显的上转换荧光发射是由常规下转换发射产生的伪像, 这些伪像是由分光光度计的单色仪中第二次衍射的泄漏成分激发.他们通过将长通滤光片插入激发源中去除泄漏成分的方法对使用5种不同方法合成的碳量子点进行上转换荧光测试, 并通过测量荧光强度与激发光强度的依懒性判断观察到的荧光是否起源于上转换.假定上转换荧光来自多光子激发过程, 此时并没有观察到荧光强度与激发光强度间的如前所述的线性关系, 因此他们对碳量子点上转换发光提出质疑.认为在解释CQD的荧光发射时必须格外小心, 并且有必要进一步澄清并解释CQD的上转换.但是, Gan等[23]指出可以通过使用足够高功率密度的脉冲激光激发证实是否有来自GQD的UCPL.他们通在800 nm飞秒脉冲激光的激发下观察到了GQD强烈的蓝光发射, 如图 7所示, 蓝色UCPL信号正确, 并且不是源自设备的伪像.激光功率和PL强度之间的二次相关性意味着当前的发射是一个双光子激发过程.通过对比已存在的碳量子点实验研究, 其上转换发光性能多通过脉冲激光器实现.因此通过分光光度计检测碳量子点上转换发光性能, 与其说是对碳量子点是否存在上转换发光能力的质疑, 不如说是对如何正确有效地检测碳量子上转换发光手段的质疑.由上述两种上转换发光机理可以推测, 激发光源的性质对碳量子点的发光性能检测具有很大的影响, 现存的质疑推进了相关研究学者更准确的判断碳量子点的上转换发光性能.

|
图 7 800 nm飞秒脉冲激光作为激发光源激发GQD的UPCL[23] Fig.7 UPCL of GQD excited by 800 nm femtosecond pulse laser[23] |
碳量子点自首次被发现以来, 已经开发出许多合成方法, 根据碳源的不同, 这些方法可以大致地分为“自上而下”(Top-down)合成法和“自下而上”(Bottom- up)合成法. “自上而下”合成法是指将大尺寸的碳源通过物理或者化学的方法剥离出尺寸很小的碳量子点.利用“自上而下”合成法合成碳量子点的碳源一般为碳纳米管、碳纤维、石墨棒、碳灰和活性炭等, 通过电弧放电、激光销蚀、电化学合成等手段将这些富碳物质进行分解并最终形成碳量子点. “自下而上”合成法与“自上而下”合成法相反, 利用分子或者离子状态等尺寸很小的碳材料合成出碳量子点.用“自下而上”法合成碳量子点, 多采用有机小分子或低聚物作为碳源, 常用的有柠檬酸、葡萄糖、聚乙二醇、尿素、离子液体等.常见的“自下而上”合成方法有化学氧化法、燃烧法、水热/溶剂热法、微波合成法、模板法等.
3.1 “自上而下”(Top-down)合成法Li及其同事[24]通过在普通有机溶剂(例如乙醇,丙酮或水)中对纳米碳粒子进行激光快速钝化的方法制备了碳量子点.所制备的碳量子点表现出了可见光区可调的和稳定的光致发光(PL)特性. Zhou等[25]通过电化学方法制备了CQD的.在电化学池中, 以碳纸上通过化学气相沉积法(CVD)制得的多壁碳纳米管(MWCNTs)作为工作电极, 铂丝作为辅助电极, Ag/AgCl作为参比电极, 含0.1 mol·L-1四丁基高氯酸铵的乙腈溶液作为电解液(实验前先除氧), 在-2.0~ +2.0 V之间循环施加扫速为0.5 V/s的电压, 可以观察到溶液由无色变为黄色, 最后再变为深棕色, 表明碳量子点从多壁碳纳米管上成功剥离下来.当用紫外灯照射时, 可发出蓝色荧光.为了大幅降低原材料成本并扩大CQD生产规模, Ming等[26]提出了一种利用低成本且容易获得的石墨作为碳源的一步电化学方法.制备的CQD主要是多层石墨烯氧化物, 其中仅用纯水作为电解质, 而没有任何其他化学添加剂.如此获得的CQD具有高结晶性、优异的水分散性、出色的PL特性(上下转换荧光发光), 并且无需进一步纯化.
3.2 “自下而上”(Bottom-up)合成法Liu及其同事[27]使用使用两亲三嵌段共聚物F127官能化的二氧化硅胶体球作为载体和可溶性酚醛树脂作为碳前体.随后高温处理去除二氧化硅载体生成了纳米级CQD.酸处理和简单的表面钝化最终产生了水溶性的多色光致发光CQD.采用表面活性剂改性的二氧化硅纳米球作为载体, 不仅为溶液中可溶性酚醛树脂的聚合提供了锚点, 而且还防止了热解过程中纳米级碳点的聚集.这种直接, 自下而上的化学合成路线的显著优势在于其低成本和高灵活性.通过改变碳前驱体(例如含N的吡咯, B和F掺杂的聚合物等), 可以将该方法扩展到合成具有不同组成的光致发光CQD.这种变化的组成可以允许对其发射波长范围的受控调节, 并帮助理解碳纳米材料的固有光致发光机理.此外, 这种多功能的表面钝化CQD已显示出非常好的生物相容性, 并且因其1.5~2.5 nm的微小尺寸, 有望成为具有单分子分辨率的潜在生物成像剂. Zhu和他的同事[28]报道了一种经济且简便的微波热解方法, 可在数分钟内合成荧光CNP.将不同量的聚乙二醇(PEG-200)和糖(葡萄糖, 果糖等)加入蒸馏水中形成透明溶液, 然后将溶液在500 W微波炉中加热2~10 min.随着实验进行, 溶液从无色变为黄色最后变为深棕色, 这暗示了CNP的形成.这种清洁、便宜、方便的路线缩短了反应时间, 有望大规模工业化制备.丰富的表面陷阱和官能团赋予它们明亮、稳定的发光和出色的水分散性.
3.3 碳量子的合成修饰修饰Ga3+离子, 可使碳量子点具有磁性, 并已经应用于核磁共振成像. Ren等[29]采用水热法制备了具有共振响应的CQDs光致发光材料, 使用钆喷酸单葡甲胺(GdPM)为单一前驱体, 既作为碳源, 又同时提供Gd3+离子, 经过220度热解8 h得到Gd3+-CQD. Gd3+-CQD的平均直径约为1.6 nm, 显示出7.1%的高光致发光量子产率以及9.87 mmol·L-1 s-1的高纵向弛豫度(r1)(图 8).由于细胞毒性不明显, Gd3+-CQD在磁共振/荧光双峰分子成像中具有很大的临床应用前景.在此研究工作中, 观察到了T1加权MRI对比的增强: (1) r1很大程度上取决于Gd3+与氢质子之间的直接相互作用, 具有高比表面积的超小Gd3+-CQD可以使Gd3+离子与氢质子之间的偶极相互作用最大化.同时, Gd3+-CQD具有优异的亲水性, 因此是增强r1的原因. (2)在Gd3+-CQD中, Gd3+离子被装载在超小的碳质核上形成了大量的受限Gd3+团簇, 这些团簇通过磁邻近效应大大增强了弛豫性能. (3) Gd3+-CQD可以互相拥抱并形成所谓的胶体纳米粒子作为次生簇, 不仅通过如上所述的磁邻近效应增强了弛豫性能, 而且还利用了相邻纳米颗粒之间的相互作用, 从而导致了原始组分中不存在的新性能(例如非常高的r1).

|
图 8 Gd3+-CQDs核磁共振图[29] Fig.8 The MR of Gd3+-CQDs (a) T1-weighted MR images (1: H2O; 2: GdPM; 3: Magnevist; 4: as-prepared Gd3+-CQDs, [Gd3+]=0.01 mmol·L-1]) and (b) Linear relationship between T1 and Gd3+ concentration for as-prepared Gd3+-CQDs[29] |
表面修饰增强荧光发光性能.光致发光(PL)是碳量子点(CQD)的核心特性, 尽管其起源仍在争论中, 但当包括胺或氨作为氮源时, 普遍观察到PL量子产率的增加. Dang等[30]首先通过水热法将柠檬酸(CA)合成了羧酸盐封端的CQD, 然后将原始CQD用EDA在160 ℃处理2 h, 在CQD的表面上形成了荧光基团(IPCA).表面IPCA导致PL增强, 并在346 nm处出现宽吸收峰.在346 nm处的宽吸收带起源于荧光团中的π→π*电子跃迁, 当用低于340 nm的波长激发时, 原始CQD在大约400和500 nm处显示两个分解的发射中心, 而EDA处理的CQD表面荧光团的发射波长约为420 nm (图 9).表面荧光团将CQD的PLQY从20.7%提高到47.6%.这些结果清楚地证明了表面荧光团对CQD, 尤其是衍生自有机酸和胺的CQD的光学性质有重要贡献.
4 碳量子点的应用碳量子点具有优秀的光学性质, 良好的水溶性、低毒性、环境友好、原料来源广、成本低、生物相容性好等诸多优点.因此其在化学分析、医学成像技术、催化剂制备、能源开发等许多的领域都有较好的应用前景.
4.1 化学分析pH响应性应用:通过选择不同的合成方法与实验试剂, 合成碳量子点可能具有不同种类与程度的含氧官能团, 因此会对其溶解性与pH感应性存在影响. Zhu等[31]通过有效的两步法(结合了“自上而下”的切割和分离路线的超声法加水热法)制备了具有可调表面化学性质(增加氧化度)的石墨烯量子点(GQD). GQD通过调控表面氧化程度, 具有良好的溶解度, 高稳定性.更重要的是, GQD具有酸碱响应特性(图 10a), 可以用作pH传感器.此外, 通过结合在水中的自由分散和上转换PL特性, GQD可以在近红外范围内用作能量收集器或生物成像探针. Sarkar等[32]同样合成了具有pH响应性的碳量子点(图 10b).他们通过将芦荟叶凝胶在250 ℃碳化2 h的方法成功制备了CQD, 且具有良好的生物相容性, 较低的细胞毒性和较高的水分散性.并因此设计了CQD定制的藻酸钙(CA)水凝胶薄膜, 目的是控制糖肽抗生素万古霉素在胃肠道(GI)中的递送.使用CQD时, CA/CQD膜的载药量从38%增加到了89%, 万古霉素的摄取量增加更至96%.万古霉素通过CA/CQD膜的释放在pH 1.5时更为明显, 接近胃的pH, 且在β-CD存在条件下, 万古霉素的释放率在120 h内降低了56%.具有β-CD的pH 1.5的环境下CA/CQD水凝胶膜的高药物吸收能力(96%)和较低的释放速率(120 h内56%)使其可作为将药物万古霉素控制释放到体内胃区域的药物输送载体, 为口服万古霉素提供潜在的选择.且该碳量子点具有发蓝光的荧光特性, 使其在细胞成像方面存在应用潜力.

|
图 10 pH对碳量子点荧光性能的影响[32-33] Fig.10 The dependence of PL emission on pH (a) PL emission of synthesized CQDs in different pH medium [32](b)PL emission of synthesized CQDs in different pH medium, digital images of pH varied CQD solution in day light and under UV lamp(λex= 360 nm) respectively[33] |
生物传感器. Li等[33]以蜡烛灰为碳源, 制备了碳量子点, 并将其用于DNA的检测.染料标记的单链DNA(ssDNA)探针通过p-p相互作用吸附到CNP表面, 从而淬灭了染料(荧光共振能量转移).在目标检测中, 形成双链DNA(dsDNA)杂合体, 恢复染料荧光, 从而确定目标DNA的存在.
4.2 生物成像表面钝化、官能团化是使相关材料更好应用于生物领域最主要的研究方法, 而碳量子点天然结构中自带的含氧官能团有助于其在合成过程中, 通过选择不同碳源及不同合成方法使其具有适用于特定场合的表面结构.这也是其在生物成像领域不断获得关注研究原因之一.
Alam等[34]采用了一种简单的一步绿色方法, 以甘蓝作为天然碳源, 通过低温碳化法合成的碳量子点(CQD), 衍生的CQD的表面被富含氧的羟基和氮高度官能化, 无需进一步修饰.该CQD在水性介质中具有优异溶解性和稳定性, 出色的抗光漂白性.在针对永生化的非致瘤性人角质细胞HaCaT的细胞活力测试中, 纯化的CQD在较高浓度(500 μg/mL)下显示出较低的细胞毒性.随后, 经CQD处理的细胞在共聚焦显微镜下在体外成像技术中显示出蓝、绿和红3种不同的颜色, 可替代荧光染料和基于重金属的QD进行体外和体内研究, 以进行早期疾病检测和快速筛选.同时, 该绿色合成方法为选择新的生物材料和一步式低温合成技术以大规模合成高质量CQD提供了新思路.

|
图 11 HaCaT细胞在有无CQDs存在下的PL成像图[34] Fig.11 Fluorescence microscope images of HaCaT cells in the presence of and in the absence of CQDs[34] (a) to (c) untreated cells; (d) to (f) treated with CQDs concentration of 500 μg/mL Cell |
Zhang等[35]制备了CdSe敏化的TiO2纳米棒阵列光电极, 并将CQDs电沉积在TiO2/CdSe核/壳NRs的表面上, 以构建CQDs/CdSe/ TiO2复合光电阳极(图 12 a). CQD可以吸收近红外光子并通过上转换效应发射可见光子以激发CdSe.随后, 在CdSe的导带中激发的电子将迅速注入TiO2的导带, 然后沿着TiO2 NRs的轴向转移到FTO衬底.电子最终将在少量外部偏置电压的帮助下转移到Pt对电极, 然后驱动氢放出反应. Li等[36]通过便捷的一步式超声处理, 制备了表面具有突出的纳米结构的碳量子点(CQDs)/Cu2O复合材料(图 12 b), 实现了全光谱范围内光催化降解罗丹明B的活性, 他们将优异的全光谱响应能力归因于Cu2O突出纳米结构的优异光反射能力和CQDs的上转换光致发光特性. Huang等[37]通过水解的方法制备上转换碳量子点(CQD)复合针铁矿(α-FeOOH)纳米杂化物(CQDs/α-FeOOH) (图 12 c). CQDs/α-FeOOH表现出的对四环素的降解效率(TC, 0.1503 min-1)约为原始α-FeOOH的3.7倍, CQDs/α-FeOOH的潜在紫外-可见-红外(UV-vis-IR)广谱响应特性被证明可以降解各种表面带电的有机污染物, 它们具有耦合上转换CQD的功能. CQDs/α-FeOOH还具有出色的耐久性, 在不同的实际水基质中具有相当好的催化性能, 甚至在真实的日光条件下也完全消除了TC的相关耐药性.良好的生物相容性使CQDs/α-FeOOH成为有前途的光催化剂, 可有效利用太阳能来修复水污染. Zhao等[38]设计合成了UV-Vis-NIR广谱驱动的碳量子点改性WO2-NaxWO3(WO2-NaxWO3-CDs)复合光催化剂材料(图 12d), 该光生载流子的分离效率, 两者协同作用下实现了无任何牺牲剂或助催化剂的条件下的完全水分解反应.当复合催化剂中CD的浓度为0.008 gCDs/gcatalyst时, 分别在紫外光(λ < 420 nm)、可见光(420 nm≤λ≤760 nm)和近红外光(λ>760 nm)照射下, 按H2/O2的化学计量比为0.05/0.02、2.58/1.24、4.74/2.28 μmol/h的产氢产氧活性, 且在6个重复实验循环中表现出出色的稳定性.

|
图 12 碳量子点在能源、催化领域的应用[35-38] Fig.12 The applications of CQDs in energy and catalysts[35-38] (a) CQDs/CdSe/TiO2 composite photoanode as a spectral converter; (b) CQDs/Cu2O composite system to achieve degradation of Rhodamine B under full solar spectrum; (c) CQDs/α-FeOOH up-conversion photocatalytic system; (d) WO2-NaxWO3-CDs photocatalytic overall water splitting under full solar spectrum |
选择性是高效传感器的重要参数, CQD由于其荧光特性已被用作传感器或荧光探针用于检测各种金属离子(例如Cu2 +, Hg2 +, Fe3+)以及检测小的有机分子(例如抗坏血酸, 柠檬酸等).碳量子点被用来检测污水或食品中的有机污染物或重金属离子的检测机理可主要分为以下3种: (1)由于被检测物质吸收光谱范围与碳量子点发射波谱范围重叠通过荧光共振能量转移发生荧光猝灭(FRET)[39]; (2)由于被检测物质吸收光谱范围与碳量子点吸收或发射波谱范围重叠通过内部滤光效应(IFE)发生荧光猝灭[40]; (3)由于被检测物质与CQD表面基团相互作用, 形成配合物将促进电荷转移并抑制激子重组, 从而导致荧光猝灭[41].
Khan等[39]使用L-赖氨酸和硫脲通过水热法制备了氮和硫掺杂的水溶性碳量子点NS-CQDs.通过对比含有不同有机物与金属离子溶液的发射荧光强度可知, 该量子点表现出对苦味酸(PA)高的选择性与灵敏性(0.24 μmol·L-1)(图 13a). PA的吸收谱图与NS-CQDs的发射谱图发生重叠, 被证明是由于荧光共振能量转移机制发生了荧光猝灭. Feng等[40]通过水热法以天然海藻为原料合成具有高荧光量子产率(QY: 20.5%)的碳量子点(CQDs).如图 13b所示, Cr(Ⅵ)吸收峰位与CQDs的激发光波长重叠, 因此CQDs的激发波长可以被Cr(Ⅵ)吸收, 导致CQDs的荧光被有效地淬灭.由于内部过滤效应(IFE)以及CQDs表面的官能团与Cr(Ⅵ)之间的强相互作用, Cr(Ⅵ)有效地淬灭了CQDs的荧光.在最佳条件下, 可检测到Cr(Ⅵ)的范围为0.01至50 μmol·L-1, 检出限为0.52 μmol·L-1. Khan等[41]还成功制备了对Fe3+离子具有高响应性的碳量子点.通过水热法以红色小扁豆为前体, 合成的水溶性氮掺杂碳量子点(N-CQDs), 在波长为365 nm的紫外灯下显示出亮蓝色荧光, 计算出的量子产率为13.2%.这些N-CQD对Fe3+离子具有高响应性, 在2~20 μmol·L-1的动态范围内, 计算的检测限(LOD)为0.10 μmol·L-1.由于添加了Fe3+离子而导致荧光猝灭的可能机理是由于Fe3+离子与N-CQDs表面上存在的羟基结合而导致形成Fe(Ⅲ)配合物螯合物(图 13 c), 电子从N-CQDs的激发态转移到Fe3+的半填充轨道的3d轨道上, 从而导致非辐射电子空穴对重组, 使N-CQD发生荧光猝灭.且所用量子点可由食物垃圾作为碳源, 不仅有助于食品安全检测, 而且还可以增加副产品的价值, 在食品质量和安全检测中存在极大应用潜力[42].
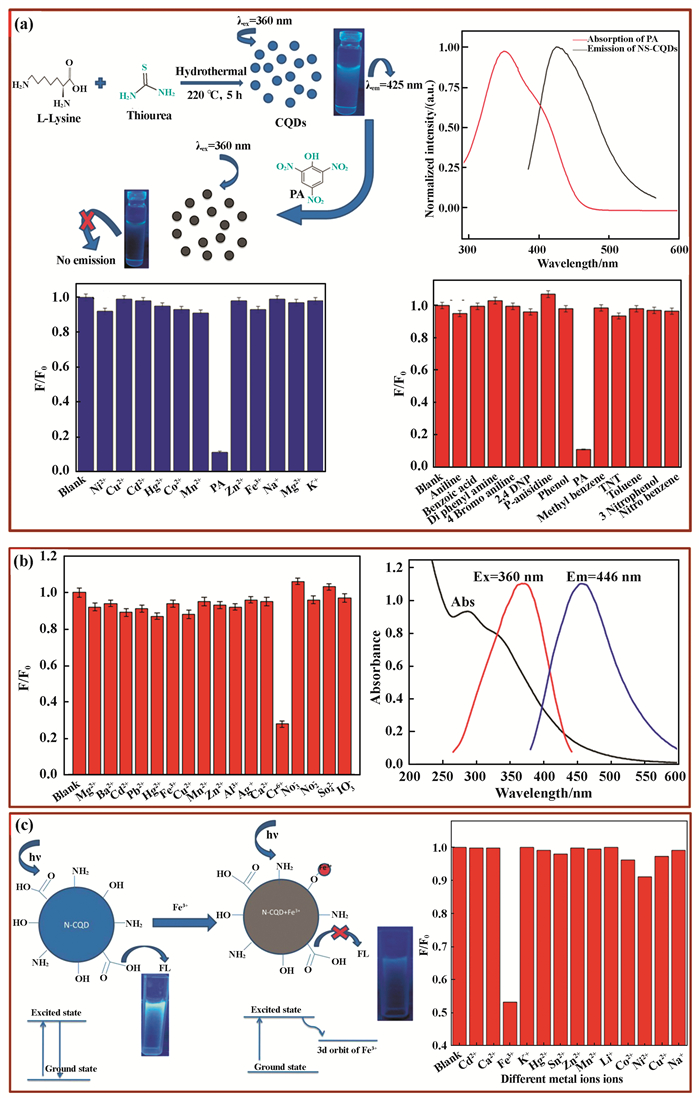
|
图 13 碳量子点应用于检测有机污染物与重金属离子[39-41] Fig.13 Carbon quantum dots are used as fluorescent probes to detect organic pollutants and heavy metal ions[39-41] |
同时, 具有与石墨烯相似结构的量子点也得到了不断的关注, 例如g-C3N4量子点, MoS2量子点等. Wang等[43]直接将块状g-C3N4通过热化学刻蚀工艺制备了石墨化氮化碳(g-C3N4)量子点(CNQDs)(图 14 a). CNQD显示出强烈的蓝光发射以及上转换发光行为, 可用作可见光驱动的无金属光催化系统中通用能量传输组件.并通过再块状g-C3N4上负载CNQD的方法构建了无金属同型异质结催化剂, 担载1%(质量分数)Pt作为助催化剂和10%的三乙醇胺作为牺牲剂的情况下, 实现了分解水产氢(600 nm截止滤光片).在使用CNQD作为能量转移组分的条件下可以有效地将可见光驱动的光催化活性提高至少2.87倍. Dong等[44]使用四丁基铵(TBA)辅助超声处理多层MoS2粉末, 并通过OH介导的链状Mo—S键断裂模式, 可控制地合成了具有所需光学性质的小尺寸MoS2量子点(QDs) (图 14 b). TBA可以插入块状MoS2的层间结构中, 以剥落单层MoS2薄片, 然后进一步将MoS2薄片切成MoS2 QD.通过简单地控制超声时间, 可以生成横向尺寸约为13 nm的MoS2薄片.所获得的MoS2量子点具有蜂窝状晶格结构, 具有均匀的晶体形状.合成的MoS2 QDs呈现出良好的下转换光致发光行为, 并且对于生物成像显示出显着的上转换光致发光.研究了新兴的光致发光机理.此外, 还证明了MoS2 QDs的1O2生产能力优于商用光敏剂PpIX, 在光动力疗法中具有巨大的潜在应用前景.

|
图 14 (a) g-C3N4量子点及其发光性能[42]; (b) MoS2量子点及其发光性能[43] Fig.14 (a) g-C3N4 QD and their luminescence properties[42]; (b) MoS2 QD and their luminescence properties[43] |
碳量子点由于其合成原料来源广泛且成本较低, 化学性质稳定, 无毒, 可通过表面修饰调节其发光性能, 因而在很多领域都获得了应用, 具有很大的潜力.碳量子点还可通过调控表面官能团作为不同重金属离子检测器及净化剂,通过不同离子掺杂进行改性,通过调控表面光能团使其更好应用于所需领域,与稀土掺杂上转换发光材料共同使用, 构建近红外光区的FRET.
| [1] |
Kitano M, Hara M. Heterogeneous photocatalytic cleavage of water[J]. J Mater Chem, 2010, 20: 627–641.
DOI:10.1039/B910180B |
| [2] |
Pollnau M, Gamelin D R, Luthi S R. Power dependence of upconversion luminescence in lanthanide and transition-metal-ion systems[J]. Phys Rev B, 2000, 62(5): 3337–3346.
|
| [3] |
Cates E L, Wilkinson A P, Kim J H. Delineatingmechanisms of upconversion enhancement by Li+ codoping in Y2SiO5:Pr3+[J]. J Phys Chem C, 2012, 116(23): 12772–12778.
DOI:10.1021/jp302515t |
| [4] |
Liao J, Yang Z, Lai S, et al. Upconversionemission enhancement of NaYF4:Yb, Er nanoparticles by coupling silver nanoparticle plasmons and photonic crystal effects[J]. J Phys Chem C, 2014, 118(31): 17992–17999.
DOI:10.1021/jp504586t |
| [5] |
Auzel F, Pecile D. Comparison and efficiency of materials for summation of photons assisted by energy transfer[J]. J Lumin, 1973, 8(1): 32–43.
|
| [6] |
Gray V, Moth-Poulsen K, Albinsson B, et al. Towards efficient solid-state triplet-triplet annihilation based photon upconversion:Supramolecular, macromolecular and self-assembled systems[J]. Coordin Chem Rev, 2018, 362: 54–71.
DOI:10.1016/j.ccr.2018.02.011 |
| [7] |
Zheng Z, Tachikawa T, Majima T. Single-particle study of Pt-modified Au nanorods for plasmon-enhanced hydrogen generation in visible to near-infrared region[J]. J Am Chem Soc, 2014, 136(19): 6870–6873.
DOI:10.1021/ja502704n |
| [8] |
Zhu S J, Zhang J H, Tang S J. Surface chemistry routes to modulate the photoluminescence of graphene quantum dots:From fluorescence mechanism to up-conversion bioimaging applications[J]. Adv Funct Mater, 2012, 22(22): 4732–4740.
DOI:10.1002/adfm.201201499 |
| [9] |
Shen J H, Zhu Y H, Chen C. Facile preparation and upconversion luminescence of graphene quantum dots[J]. Chem Commun, 2011, 47(9): 2580–2582.
DOI:10.1039/C0CC04812G |
| [10] |
Xu X Y, Ray R, Gu Y L, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. J Am Chem Soc, 2004, 126: 12736–12737.
DOI:10.1021/ja040082h |
| [11] |
Sun Y P, Zhou B, Lin Y. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. J Am Chem Soc, 2006, 128(24): 7756–7757.
DOI:10.1021/ja062677d |
| [12] |
Demchenko A P, Dekaliuk M O. Novel fluorescent carbonic nanomaterials for sensing and imaging[J]. Methods Appl Fluoresc, 2013, 1(4): 042001.
DOI:10.1088/2050-6120/1/4/042001 |
| [13] |
Yang S T, Cao L, Luo P G, et al. Carbondots for optical imaging in vivo[J]. J Am Chem Soc, 2009, 131(32): 11308–11309.
DOI:10.1021/ja904843x |
| [14] |
Lim S Y, Shen W, Gao Z Q. Carbon quantum dots and their applications[J]. Chem Soc Rev, 2015, 44(1): 362–381.
DOI:10.1039/C4CS00269E |
| [15] |
Yan X, Li B, Cui X, et al. Independent tuning of the band gap and redox potential of grapheme quantum dots[J]. J Phys Chem Lett, 2011, 2: 1119–1124.
DOI:10.1021/jz200450r |
| [16] |
Lin L X, Zhang S W. Creating high yield water soluble luminescent graphene quantum dots via exfoliating and disintegrating carbon nanotubes and graphite flakes[J]. Chem Commun, 2012, 48(82): 10177–10179.
DOI:10.1039/c2cc35559k |
| [17] |
Xu Q F, Zhou Q, Hua Z, et al. Single-particle spectroscopic measurements of fluorescent graphene quantum dots[J]. ACS Nano, 2013, 7(12): 10654–10661.
DOI:10.1021/nn4053342 |
| [18] |
Li H T, He X D, Kang Z H, et al. Water-soluble fluorescent carbon quantum dots and photocatalyst design[J]. Angew Chem Int Edit, 2010, 122(26): 4532–4536.
DOI:10.1002/ange.200906154 |
| [19] |
Cao L, Wang X, Meziani M J, et al. Carbondots for multiphoton bioimaging[J]. J Am Chem Soc, 2007, 129(37): 11318–11319.
DOI:10.1021/ja073527l |
| [20] |
Zhuo S J, Shao M W, Lee S T. Upconversion and downconversion fluorescent graphene quantum dots:Ultrasonic preparation and photocatalysis[J]. ACS Nano, 2012, 6(2): 1059–1064.
DOI:10.1021/nn2040395 |
| [21] |
Shen J H, Zhu Y H, Chen C. Facile preparation and upconversion luminescence of graphene quantum dots[J]. Chem Commun, 2011, 47(9): 2580–2582.
DOI:10.1039/C0CC04812G |
| [22] |
Wen X M, Yu P, Toh Y R, et al. On the upconversion fluorescence in carbon nanodots and graphene quantum dots[J]. Chem Commun, 2014, 50(36): 4703–4706.
DOI:10.1039/C4CC01213E |
| [23] |
Gan Z X, Wu X L, Zhou G X. Is Therereal upconversion photoluminescence from graphene quantum Dots[J]. Adv Optical Mater, 2013, 1(8): 554–558.
DOI:10.1002/adom.201300152 |
| [24] |
Li X Y, Wang H Q, Shimizu Y, et al. Preparation of carbon quantum dots with tunable photoluminescence by rapid laser passivation in ordinary organic solvents[J]. Chem Commun, 2010, 47(3): 932–934.
|
| [25] |
Zhou J G, Booker C, Li R Y, et al. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J]. J Am Chem Soc, 2007, 129(4): 744–745.
DOI:10.1021/ja0669070 |
| [26] |
Ming H, Ma Z, Liu Y, et al. Large scale electrochemical synthesis of high quality carbon nanodots and their photocatalytic property[J]. Dalton Trans, 2012, 41(31): 9526–9531.
DOI:10.1039/c2dt30985h |
| [27] |
Liu R, Wu D, Liu S, et al. An aqueous route to multicolor photoluminescent carbon dots using silica spheres as carriers[J]. Angew Chem Int Edit, 2009, 48(25): 4598–4601.
DOI:10.1002/anie.200900652 |
| [28] |
Zhu H, Wang X, Li Y, et al. Microwave synthesis of fluorescent carbon nanoparticles with electrochemiluminescence properties[J]. Chem Commun, 2009, 2009(34): 5118–5120.
|
| [29] |
Ren X Y, Yuan X X, Wang Y P, et al. Facile preparation of Gd3+ doped carbon quantum dots:Photoluminescence materials with magnetic resonance response as magnetic resonance/fluorescence bimodal probes[J]. Opt Mater, 2016, 57: 56–62.
DOI:10.1016/j.optmat.2016.04.018 |
| [30] |
Dang T H T, Mai V T, Le Q T, et al. Post-decorated surface fluorophores enhance the photoluminescence of carbon quantum dots[J]. Chem Phys, 2019, 527: 110503.
DOI:10.1016/j.chemphys.2019.110503 |
| [31] |
Zhu S J, Zhang J H, Liu X. Graphene quantum dots with controllable surface oxidation, tunable fluorescence and up-conversion emission[J]. RSC Advances, 2012, 2(7): 2717–2720.
DOI:10.1039/c2ra20182h |
| [32] |
Sarkar N, Sahoo G, Das R, et al. Carbon quantum dot tailored calcium alginate hydrogel for pH responsive controlled delivery of vancomycin[J]. Eur J Pharm Sci, 2017, 109: 359–371.
DOI:10.1016/j.ejps.2017.08.015 |
| [33] |
Li H L, Zhang Y W, Wang L, et al. Nucleic acid detection using carbon nanoparticles as a fluorescent sensing platform[J]. Chem Commun, 2010, 47(3): 961–963.
|
| [34] |
Alam A M, Park B Y, Ghouri Z K. Synthesis of carbon quantum dots from cabbage with down-and up-conversion photoluminescence properties:Excellent imaging agent for biomedical applications[J]. Green Chem, 2015, 17(7): 3791–3797.
DOI:10.1039/C5GC00686D |
| [35] |
Zhang X, Huang H, Liu J, et al. Carbon quantum dots serving as spectral converters through broadband upconversion of near-infrared photons for photoelectrochemical hydrogen generation[J]. J Mater Chem A, 2013, 1(38): 11529–11533.
DOI:10.1039/c3ta12568h |
| [36] |
Li H, Liu R, Liu Y, et al. Carbon quantum dots/Cu2O composites with protruding nanostructures and their highly efficient (near) infrared photocatalytic behavior[J]. J Mater Chem, 2012, 22(34): 17470–17475.
DOI:10.1039/c2jm32827e |
| [37] |
Huang S, Zhang Q, Liu P, et al. Novel up-conversion carbon quantum dots/α-FeOOH nanohybrids eliminate tetracycline and its related drug resistance in visible-light responsive Fenton system[J]. Appl Catal B:Environ, 2020, 263: 118336–118347.
DOI:10.1016/j.apcatb.2019.118336 |
| [38] |
Zhao J, Liu C, Wang H, et al. Carbon dots modified WO2-NaxWO3 composite as UV-Vis-NIR broad spectrum-driven photocatalyst for overallwater splitting[J]. Catal Today, 2020, 340: 152–160.
DOI:10.1016/j.cattod.2018.11.028 |
| [39] |
Khan Z M S, Saifi S, Shumaila A Z, et al. Afacile one step hydrothermal synthesis of carbon quantum dots for label-free fluorescence sensing approach to detect picric acid in aqueous solution[J]. J Photoch Photobio A, 2020, 338: 112201.
|
| [40] |
Feng S, Gao Z, Liu H, et al. Feasibility of detection valence speciation of Cr(Ⅲ) and Cr(Ⅵ) in environmental samples by spectrofluorimetric method with fluorescent carbon quantum dots[J]. Spectro Chim Acta A, 2019, 212: 286–292.
DOI:10.1016/j.saa.2018.12.055 |
| [41] |
Khan Z M S H, Rahman R S, Shumaila , et al. Hydrothermal treatment of red lentils for the synthesis of fluorescent carbon quantum dots and its application for sensing Fe3+[J]. Opt Mater, 2019, 91: 386–395.
DOI:10.1016/j.optmat.2019.03.054 |
| [42] |
Fan H, Zhang M, Bhandari B, et al. Food waste as a carbon source in carbon quantum dots technology and their applications in food safety detection[J]. Trends Food Sci Tech, 2020, 95: 86–96.
DOI:10.1016/j.tifs.2019.11.008 |
| [43] |
Wang W, Yu J C, Shen Z, et al. g-C3N4 quantum dots:direct synthesis, upconversion properties and photocatalytic application[J]. Chem Commun, 2014, 50(70): 10148–10150.
DOI:10.1039/C4CC02543A |
| [44] |
Dong H, Tang S, Hao Y, et al. Fluorescent MoS2 quantum dots:Ultrasonic preparation, up-conversion and down-conversion bioimaging, and photodynamic therapy[J]. ACS Appl Mater Inter, 2016, 8(5): 3107–3114.
DOI:10.1021/acsami.5b10459 |
 2020, Vol. 34
2020, Vol. 34







