醛或酮是现代合成化学和化工行业中最重要的官能团转化中间体之一, 其主要来源是相应醇选择性氧化[1]. 传统的醇氧化通常以化学当量过渡金属氧化物, 如高锰酸钾、氧化锰、氧化铬和重铬酸钾等作为氧化剂, 然而该反应副产物较多, 易发生过氧化、毒性大. 利用过渡金属或有机小分子催化剂的需氧氧化(aerobic oxidation)是目前实现醇选择性氧化的主要途径. 如Pd[2-4]、Ru[5-7]、Au[8-10]等贵金属纳米颗粒或稳定的氮氧自由基小分子(如2, 2, 6, 6-四甲基哌啶氧自由基, TEMPO)是目前需氧氧化最常见的催化剂. 然而, 上述体系存在贵金属通常价格较高昂或反应需卤素、碱和复杂配体等作为辅助催化剂等问题[11-16], 不利于所合成的醛作为医药中间体、香料和食品添加剂领域的应用. 相比于贵金属, 铁盐具有价廉易得、低毒等特点, 将其与有机小分子催化剂组成醇催化体系得到了广泛关注[17-23]. Martin等[24]报道Fe(NO3)3/FeBr3体系能够实现二级脂肪醇的催化氧化. Dijksman等[6]将铁盐与氮氧自由基小分子(2, 2, 6, 6-四甲基哌啶氧自由基, TEMPO), 组成Fe(Ⅲ/Ⅱ)氯化物/TEMPO共催化体系实现2-辛醇催化氧化. Wang等[25]和Yin等[26]开发的FeCl3·6H2O/TEMPO/NaNO2三组分体系可氧化一系列苄醇、杂环醇和脂肪醇. 然而, 上述均相催化体系仍然存在游离的Fe3+残留问题.
金属-有机骨架材料(Metal-Organic Framew-orks, MOFs)具有规则的孔道结构、高比表面积、丰富不饱和金属位点等特征, 被广泛应用于催化领域[27-29]. MIL-101(Fe)是由[Fe3(μ3-O)]节点与1, 4-对苯二甲酸(H2bdc)配位形成具有三维规则孔道的Fe-MOF. MIL-101(Fe)含有介孔(2.9~3.4 nm)和微孔窗口(1.2~1.4 nm), 其空配位的Fe(Ⅲ)金属位点可作为Lewis酸成为后修饰(Postsynthetic modification, PSM)的功能化位点[30-31]. 例如, Barbosa等[32]发现MIL-101(Fe)可作为1, 2-环氧环己烷和苯胺开环反应的催化剂. Zhao等[33]以制备出三明治核壳结构的MIL-101(Fe)@Pt@MIL-101(Fe), 在αβ-不饱和醛选择性加氢反应中表现出优异的催化活性和加氢位点选择性. Wang等[34]发现可见光照射下, NH2-MIL-101(Fe)可实现芳香醇和活性亚甲基化合物一锅串联反应. 将TEMPO自由基与MOFs联合使用, 可实现醇类化合物的选择性需氧氧化[35-39].
目前常见的TEMPO/MOFs复合催化体系通常使用未功能化的TEMPO分子, 我们设想将TEMPO进行预功能化使其能与MOFs的金属离子节点配位, 能有效提高TEMPO在MOFs孔道内的负载量, 从而提高TEMPO/MOFs复合催化体系的催化效率. 为此, 我们提出利用酰胺化反应在TEMPO分子的4位引入乙酰氨基和异烟酰氨基分别获得Acet-TEMPO和isoNTA-TEMPO分子. 将Acet-TEMPO、isoNTA-TEMPO和TEMPO分别与MIL-101(Fe)组成共催化体系, 通过研究苯甲醇氧化反应, 可比较MIL-101(Fe)/isoNTA-TEMPO、MIL-101(Fe)/Acet-TEMPO和MIL-101(Fe)/TEMPO 3种催化体系的催化性能差异, 从而探讨TEMPO功能化基团, 特别是吡啶配位基团, 对复合体系催化性能的影响, 从而揭示MOFs/TEMPO协同催化的机理.
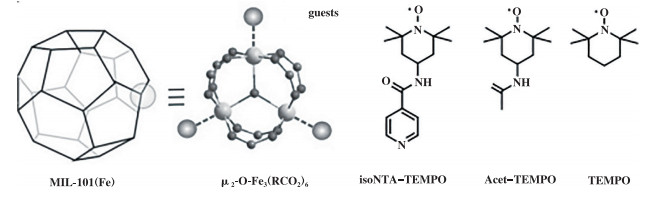
|
图示1 MIL-101(Fe)的结构示意图以及isoNTA-TEMPO、Acet-TEMPO和TEMPO的结构式 Scheme 1 The structural scheme of MIL-101(Fe) and the structural formulas of isoNTA-TEMPO, Acet-TEMPO and TEMPO |
N, N-二甲基甲酰胺(DMF, 分析纯)购于伊诺凯科技有限公司;二环己基碳二亚胺(DCC, 分析纯)、1-羟基苯并三唑(HOBt, 分析纯)、实验所使用的各种醇(分析纯)均购于北京百灵威科技有限公司;四正丁基六氟磷酸铵(TBAF, 分析纯)、异烟酸(分析纯)、异烟酰胺(isoNTAmide, 分析纯)、4-氨基-2, 2, 6, 6-四甲基哌啶-1-氧自由基(分析纯)、2, 2, 6, 6-四甲基哌啶-1-氧自由基(TEMPO, 分析纯)、4-乙酰氨-2, 2, 6, 6-四甲基哌啶-1-氧自由基(Acet-TEMPO, 分析纯)、六水三氯化铁(Fe(Cl)3·6H2O, 分析纯)、1, 4-对苯甲酸(H2bdc, 分析纯)均购于上海安耐吉化学有限公司.
1.2 水热法制备MIL-101(Fe)在玻璃瓶中依次加入FeCl3·6H2O(675.0 mg, 2.5 mmol)、H2bdc(203.8 mg, 1.23 mmol)和DMF(15 mL), 室温下超声完全溶解, 转移至20 mL内衬为聚四氟乙烯的反应釜中, 110 ℃反应24 h, 自然冷却至室温, 离心收集红棕色固体, 用DMF回流14 h, EtOH索氏提取24 h后, 置于80 ℃真空干燥箱中干燥整晚, 即可得到红棕色MIL-101(Fe)固体粉末, 称量所得固体粉末质量为168.6 mg.
1.3 MIL-101(Fe)的表征采用Nicolet iS5红外光谱仪(FTIR, KBr压片, 扫描范围为4000 ~ 400 cm-1)分析MIL-101(Fe)的官能团;Rigaku Ultima Ⅳ型X射线衍射仪(XRD, Cu靶Kα辐射源(λ=0.151 18 nm), 工作电压为40 kV, 工作电流为30 mA, 扫速为5(°)·min-1, 2θ范围为3°~ 30°)对其进行物相分析;STA-449-F3型热重分析仪(TGA, 加热范围为40 ~ 800 ℃, N2氛围, 加热速率为10 ℃/min)测试其热稳定性;HITACHI S-4800场发射扫描电镜(SEM, 加速电压为10 kV)分析其形貌.
1.4 功能化TEMPO分子合成isoNTA-TEMPO的制备如示意图 2所示: 在50 mL圆底烧瓶中依次加入异烟酸(246.2 mg, 2.0 mmol)、DCC(494.8 mg, 2.4 mmol)和HOBt(324.3 mg, 2.4 mmol), 在N2保护下加入10 mL二氯甲烷, 于冰水浴(0 ℃)中反应30 min. 称取4-氨基-2, 2, 6, 6-四甲基哌啶-1-氧自由基(342.5 mg, 2.0 mmol)于10 mL玻璃瓶中, 加入5 mL二氯甲烷, 室温超声完全溶解后滴加至圆底烧瓶中, 室温下反应12 h, 反应液通过硅藻土过滤, 滤液浓缩后得到的粗产品为浓稠油状, 经过层析柱色谱纯化, 得到415.3 mg红棕色固体isoNTA-TEMPO, 产率为75.1%. 采用AVANCE Ⅲ 400 MHz型核磁共振波谱仪(NMR)和X500R QTOF型高分辨质谱仪(HRMS)对其结构进行确证. 1H NMR(500 MHz, DMSO-d6, 添加5 μL苯肼), δ: 8.70(d, 2H), 7.72(d, 2H), 7.71(s, 1H), 4.02(g, 1H), 1.74(d, 2H), 1.50(d, 2H), 1.10(d, 12H). 13C NMR(500 MHz, DMSO-d6), δ: 164.47, 150.58, 128.77, 121.71, 59.40, 45.04, 33.13, 20.10. MALDI-TOF-MS: m/Z: 277.17, 计算值: [M+H]=277.18.
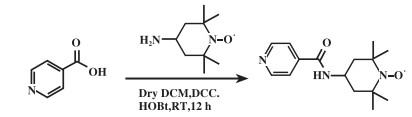
|
图示2 isoNTA-TEMPO的合成 Scheme 2 Synthetic route of isoNTA-TEMPO |
采用上海辰华CHI 660e电化学工作站对isoNTA-TEMPO、Acet-TEMPO和TEMPO进行循环伏安测试(CV, 在三电极体系中, 以Ag/AgCl电极为参比电极, 铂丝为对电极, 玻碳电极为工作电极, isoNTA-TEMPO、Acet-TEMPO和TEMPO浓度均为1 mmol/L的乙腈溶液, 支持电解质为50 mmol/L四正丁基六氟磷酸铵的乙腈溶液, 扫描速度为50 mV/s, 扫描范围为0.3 ~1.2 V).
1.6 MIL-101(Fe)与TEMPO自由基协同催化在10 mL反应釜中依次加入苯甲醇(0.1 mmol)、MIL-101(Fe)(5%(摩尔分数))、isoNTA-TEMPO/Acet-TEMPO/TEMPO(5%(摩尔分数))、TBN(20%(摩尔分数))和三氟甲苯(0.5 mL), 鼓氧气, 密闭反应釜, 80 ℃烘箱中反应90 min, 冷却后添加内标物硝基苯(0.1 mmol), 离心取上清液经GC-9160气相色谱仪(配备2B3-7-002毛细管柱30 m×0.32 mm×0.50 μm和氢火焰离子化检测器;初始温度为: 进样器温度250 ℃, 检测器温度250 ℃, 柱炉温度80 ℃;柱炉升温程序为: 初始温度保持5 min, 升温速率20 ℃/min, 保持温度250 ℃, 保持时间5 min)检测, 计算出苯甲醇氧化为苯甲醛的转化率和选择性.
1.7 MIL-101(Fe)吸附isoNTA-TEMPO在10 mL内衬为聚四氟乙烯的反应釜中加入MIL-101(Fe)(33 mg)和5 mL 10 mmol/L的isoNTA-TEMPO三氟甲苯溶液, 超声混合均匀, 密闭反应釜, 置于80 ℃烘箱中反应1.5 h后, 自然冷却至室温, 离心取上清液经UV-2450型紫外-可见分光光度计检测MIL-101(Fe)对isoNTA-TEMPO的吸附性能.
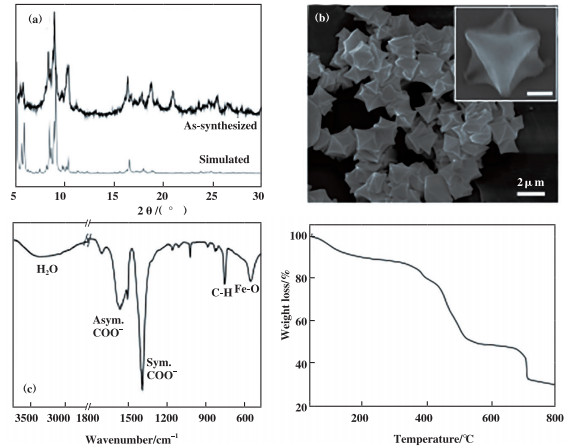
2 结果与讨论 2.1 MIL-101(Fe)的表征图 1(a)为所合成MIL-101(Fe)的粉末X-射线衍射(XRD)谱图, 其特征衍射峰与文献报道[40]基本一致, 通过对比单晶模拟XRD图案, 表明所合成的MIL-101(Fe)为单一纯相. 图 1(b)为MIL-101(Fe)的扫描电子显微镜(SEM)照片, 可看出MIL-101(Fe)为正八面体微米颗粒, 平均粒径约为2 μm, 从放大的SEM图中可观察(111)晶面明显内凹. 图 1(c)为MIL-101(Fe)的傅里叶变换红外光谱(FTIR), 3300 ~ 3700 cm-1范围的宽峰表明MIL-101(Fe)吸附了大量水分子;1564和1387 cm-1处的谱峰为羧基非对称和对称伸缩振动;748 cm-1处的吸收峰归属于苯环上C-H面内弯曲振动;547 cm-1处的吸收峰归属于Fe-O的伸缩振动. 图 1(d)为MIL-101(Fe)的TGA曲线, 在40~170 ℃之间的重量损失是由于孔道内溶剂分子被移除;MIL-101(Fe)的骨架从350 ℃开始分解, 直到700 ℃完全分解.
|
图 1 MIL-101(Fe)的(a)粉末XRD图、(b)SEM图、(c)FTIR谱图和(d)TGA曲线 Fig.1 (a) Powder XRD patterns, (b) SEM image, (c) FTIR spectrum and (d) TGA curves of MIL-101(Fe) |
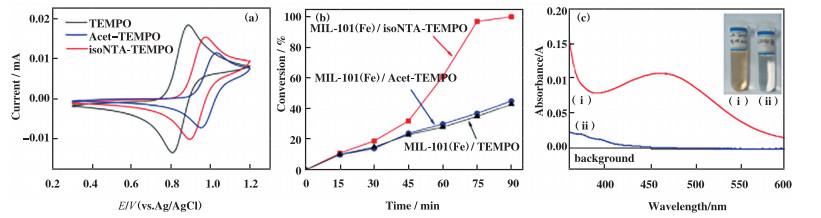
选择苯甲醇选择性氧化为苯甲醛做模型反应, 研究MIL-101(Fe)与上述TEMPO分子组成的催化体系的催化性能, 实验结果如表 1所示. 首先, 研究了isoNTA-TEMPO、Acet-TEMPO和TEMPO作为均相催化剂时, 各自的催化性能. 在相同反应条件下, 经过1.5 h后, 3者催化苯甲醇的转化率分别为64%、33%和18%(表 1 No. 1-3), 表明isoNTA-TEMPO的催化性能明显优于Acet-TEMPO和TEMPO. 从热力学角度看, 氮氧自由催化活性取决于其氧化还原电对(氮氧自由基/鎓氧正离子)的氧化还原电势[41], 利用电化学循环伏安法研究了isoNTA-TEMPO、Acet-TEMPO和TEMPO的氧化还原电位, 结果如图 2(a)所示. isoNTA-TEMPO、Acet-TEMPO和TEMPO在玻碳电极的氧化还原半波电位分别为0.93、0.99和0.85 V(vs. Ag/AgCl). 相比于TEMPO, isoNTA-TEMPO和Acet-TEMPO的氧化还原电位较正, 两者的催化活性比TEMPO高, 该结果与上述热力学观点相符. 然而, 对于isoNTA-TEMPO和Acet-TEMPO, 催化性能与氧化还原电位成相反的结果, 可能的原因是isoNTA-TEMPO碱性吡啶基团有利于提高催化反应动力学[42].
| 表 1 MIL-101(Fe)分别与isoNAT-TEMPO、Acet-TEMPO和TEMPO组成催化体系氧化苯甲醇性能 Table 1 Catalytic properties of the MIL-101(Fe) together with isoNAT-TEMPO, Acet-TEMPO, and TEMPO, respectively, for the oxidation of benzyl alcohol. conditions |
|
图 2 (a)isoNTA-TEMPO(1 mmol/L)、Acet-TEMPO(1 mmol/L)和TEMPO(1 mmol/L)的循环伏安图; (b)MIL-101(Fe)分别与isoNTA-TEMPO(虚线)、Acet-TEMPO(灰色实线)和TEMPO(黑色实线)催化苯甲醇氧化的转化率与时间的关系图;(c)isoNTA-TEMPO被MIL-101(Fe)吸附前(虚线, ⅰ)和吸附后(实线, ⅱ)的紫外-可见吸收光谱 Fig.2 (a) Cyclic voltammograms of isoNTA-TEMPO (1 mmol/L)、Acet-TEMPO (1 mmol/L) and TEMPO (1 mmol/L); (b) Conversion versus time curves for benzyl alcohol oxidation catalyzed by MIL-101(Fe) with isoNTA-TEMPO (dash line), Acet-TEMPO (grey solid line) and TEMPO (black solid line), respetively; (c) UV-Vis spectra of isoNTA-TEMPO before (dash line, ⅰ) and after (solid line, ⅱ) adsorbed by MIL-101(Fe) |
当上述3个均相反应体系中加入MIL-101(Fe)组成共催化体系, 相同反应条件下, MIL-101(Fe)/isoNTA-TEMPO体系中的苯甲醇转化率大于99%(表 1 No. 4), 而MIL-101(Fe)/Acet-TEMPO和MIL-101(Fe)/TEMPO体系的苯甲醇转化率分别为45%和43%(表 1 No. 5和6). 上述结果表明MIL-101(Fe)对3种TEMPO自由基催化活性均有所提升, 但MIL-101(Fe)与isoNTA-TEMPO组成的体系催化活性最高. 考虑到isoNTA-TEMPO和Acet-TEMPO的主要区别在于吡啶官能团, 因此可以推测MIL-101(Fe)/isoNTA-TEMPO复合体系优于MIL-101(Fe)/Acet-TEMPO体系的最重要原因在于: isoNTA-TEMPO的吡啶官能团与MIL-101(Fe)的空配位金属离子节点配位, 从而活化了MIL-101(Fe)的Fe簇, 增强催化效率. 为了进一步证明吡啶配位作用对Fe簇的活化作用, 以异烟酰胺/TEMPO/MIL-101(Fe)/TBN组成催化体系, 在相同条件下, 发现苯甲醇完全转化为苯甲醛(No.7), 从而证实了吡啶基团对Fe簇的活化作用. 但催化体系不含TBN时, 即使将反应延长至24 h, 3种催化体系均无法有效催化苯甲醇的转化(< 20%, 表 1 No. 8-10).
图 2(b)为不同反应时间段内3种催化剂对苯甲醇转化率随时间变化关系图. 当反应时间在30 min内, 3者对苯甲醇催化效果相当, 分别为19%、14%和15%. 随着反应时间延长, MIL-101(Fe)/isoNTA-TEMPO催化苯甲醇的效率显著高于另外两种催化体系. 上述结果表明随着反应时间增加, isoNTA-TEMPO进入MIL-101(Fe)孔道的量增多, 且由于isoNTA-TEMPO的吡啶基团的锚定作用, isoNTA-TEMPO(部分)锚定在MOFs孔道内. 而对于Acet-TEMPO和TEMPO, 进入和游离出MOFs的速度相当, 催化速率(图中的斜率)随时间变化较小. 紫外-可见吸收光谱进一步证实了MIL-101(Fe)对iso-NTA-TEMPO的锚定作用. 如图 2c所示, iso-NTA-TEMPO与MIL-101(Fe)充分混合, 离心除去MIL-101(Fe)后, 发现isoNTA-TEMPO几乎完全被MIL-101(Fe)吸附, 溶液颜色由吸附前的淡黄色(ⅰ)变成无色(ⅱ).
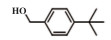
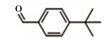
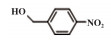
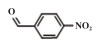
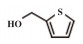
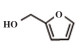
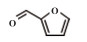
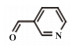
为了考察MIL-101(Fe)/isoNTA-TEMPO催化体系对底物的普适性, 探索了各种醇在最优反应条件下的转化效果. 实验结果如表 2所示, 对于含有吸电子或供电子基团的一级芳香醇和二级芳香醇, 反应1.5 h, 所有底物均完全转化成相应的醛或酮(表 2 No.1-6). 对于含S、O和N杂原子醇(表 2 No.7-9)和二级脂肪醇(表 2 No. 10), 延长反应时间至4或6 h, 也可实现完全转化.
| 表 2 MIL-101(Fe)/isoNTA-TEMPO体系对各种芳香醇的催化氧化性能 Table 2 Catalytic properties of MIL-101(Fe)/isoNTA-TEMPO toward the oxidation of a wide range of aromatic alcohols |
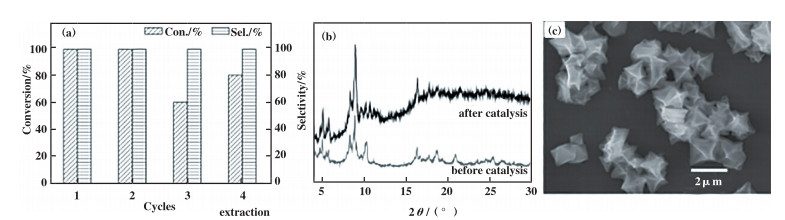
MIL-101(Fe)/isoNTA-TEMPO体系循环利用第2次仍具有优异的催化活性, 在相同反应条件下, 苯甲醇完全转化为苯甲醛. 循环利用第3次时, 发现苯甲醇的转化率明显下降, 仅为60%(图 3a). XRD和SEM结果表明, 使用3次后的MIL-101(Fe)的结构和形貌未发生显著变化. MIL-101(Fe)催化效率降低的可能原因是MIL-101(Fe)孔道被反应物堵塞或者MIL-101(Fe)的Fe簇与产物配位, 导致isoNTA-TEMPO无法与Fe簇有效结合. 将使用3次后的催化剂利用甲醇通过索氏提取24 h后, 重新与isoNTA-TEMPO组成催化体系, 相同反应条件下, 苯甲醇转化为苯甲醛的转化率从60%提高至80%, 表明甲醇萃取在一定程度上能重新活化MIL-101(Fe), 但效果未能恢复到初始状态. 后续工作将聚焦于以多氮有机分子(如2, 2’: 6’, 2’’-三联吡啶和吡唑类分子)作为桥连基团修饰TEMPO分子, 提高功能化TEMPO与MOFs金属离子节点的锚定作用.
|
图 3 (a)MIL-101(Fe)的循环使用性能;(b)和(c)为MIL-101(Fe)3次循环后的SEM图和粉末XRD图谱;(d)为MIL-101(Fe)吸附isoNTA-TEMPO的紫外-可见光谱 Fig.3 Cyclic activity of MIL-101(Fe) (a), SEM image and PXRD pattern of the MOF after 3th run (b, c); MIL-101(Fe) adsorption of isoNTA-TEMPO ultraviolet-visible spectrum (d) |
综上所述, 我们探索了isoNTA-TEMPO、Acet-TEMPO和TEMPO分别与MIL-101(Fe)形成复合催化剂在选择性氧化苯甲醇至苯甲醛的催化性能, 发现以三氟甲苯为溶剂, 反应温度80 ℃, TBN(20%(Mole fraction))为辅助剂, 氧气氛围, 3种催化体系的催化活顺序为: MIL-101(Fe)/isoNTA-TEMPO > MIL-101(Fe)/Acet-TEMPO > MIL-101(Fe)/TEMPO. 通过对比实验发现isoNTA-TEMPO的吡啶官能团与MIL-101(Fe)的Fe簇配位作用是提高体系催化性能的关键因素. MIL-101(Fe)/isoNTA-TEMPO催化体系对各种芳香醇均表现出较好的催化性能. 催化剂可循环利用, 但经过3次催化反应后, 催化剂性能降低较为明显, 循环利用性能有待进一步改进.
| [1] |
a. Sheldon R A. Recent advances in green catalytic oxidations of alcohols in aqueous media[J]. Catal Today, 2015, 247: 4-13. b. Xia Yu-yan(夏语嫣), Lv Qing-yang(吕庆阳), Yuan hua(袁华). Co-N-C System catalyzed the ammoxidation of α-aromatic alcohol to α-aromatic nitrile directly(Co-N-C体系催化α-芳香醇氨氧化直接制备α-芳香腈)[J]. J Mol Catal(China)(分子催化), 2021, 35(1): 48-53. c. Lu Zi-xuan(卢自轩), Li Shuang-ming(李双明), Yu San-san(于三三). Research progress of composite me-tal oxide catalysts for the oxidation of glycerol to acrylic acid(复合金属氧化物催化剂用于甘油氧化制丙烯酸的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(5): 484-494. |
| [2] |
a. Steinhoff B A, Fix S R, Stahl S S. Mechanistic study of alcohol oxidation by the Pd (OAc)2/O2/DMSO catalyst system and implications for the development of improved aerobic oxidation catalysts[J]. J Am Chem Soc, 2002, 124(5): 766-767. b. Zhang Nan(张楠), Li Jian-min(李建民), Liu Hai-jin(刘海津), et al. Preparation of Ag-Pd/g-C3 N4 and selective oxidation of benzyl alcohol in aqueous solution(Ag-Pd/g-C3 N4的制备及在水溶液中选择性氧化苯甲醇)[J]. J Mol Catal(China)(分子催化), 2019, 33(1): 75-82. |
| [3] |
Peterson K P, Larock R C. Palladium-catalyzed oxidation of primary and secondary allylic and benzylic alcohols[J]. J Org Chem, 1998, 63(10): 3185–3189.
DOI:10.1021/jo971268k |
| [4] |
Wang L Y, Li J, Lv Y, et al. Aerobic alcohol oxidation using a PdCl2/N, N-dimethylacetamide catalyst system under mild conditions[J]. J Org Chem, 2011, 696(20): 3257–3263.
DOI:10.1016/j.jorganchem.2011.07.019 |
| [5] |
Shimizu H, Onitsuka S, Egami H, et al. Ruthenium (salen)-catalyzed aerobic oxidative desymmetrization of meso-Diols and its kinetics[J]. J Am Chem Soc, 2005, 127(15): 5396–5413.
DOI:10.1021/ja047608i |
| [6] |
Dijksman A, Marino-Gonzalez A, Mairata i Payeras A, et al. Efficient and selective aerobic oxidation of alcohols into aldehydes and ketones using ruthenium/TEMPO as the catalytic system[J]. J Am Chem Soc, 2001, 123(28): 6826–6833.
DOI:10.1021/ja0103804 |
| [7] |
Matsumoto T, Ueno M, Kobayashi J, et al. Polymer incarcerated ruthenium catalyst for oxidation of alcohols with molecular oxygen[J]. Adv Synth Catal, 2007, 349(4/5): 531–534.
|
| [8] |
Guan B, Xing D, Cai G, et al. Highly selective aerobic oxidation of alcohol catalyzed by a gold (Ⅰ) complex with an anionic ligand[J]. J Am Chem Soc, 2005, 127(51): 18004–18005.
DOI:10.1021/ja055398j |
| [9] |
Karimi B, Esfahani F K. Gold nanoparticles supported onCs2CO3 as recyclable catalyst system for selective aerobic oxidation of alcohols at room temperature[J]. Chem Commun, 2009, 41(37): 5555–5557.
|
| [10] |
Lucchesi C, Inasaki T, Miyamura H, et al. Aerobic oxidation of alcohols under mild conditions catalyzed by novel polymer‐incarcerated, carbon‐stabilized gold nanoclusters[J]. Adv Synth Catal, 2008, 350(13): 1996–2000.
DOI:10.1002/adsc.200800319 |
| [11] |
Jiang N, Ragauskas A J. Cu (Ⅱ)-catalyzed selective aerobic oxidation of alcohols under mild conditions[J]. J Org Chem, 2006, 71(18): 7087–7090.
DOI:10.1021/jo060837y |
| [12] |
Gamez P, Arends I W C E, Reedijk J, et al. Copper (Ⅱ)-catalysed aerobic oxidation of primary alcohols to aldehydes[J]. Chem Commun, 2003, 2003(19): 2414–2415.
|
| [13] |
Wang Yi-bo(王怡博), Huang Da-fu(黄大富), Liang Zi-hao(梁子颢), et al. Highly selective TEMPO-catalyzed hydroxyl oxidation(2, 2, 6, 6-四甲基哌啶氧化物催化的高选择性羟基氧化反应)[J]. Chem J Chin Univer(高等学校化学学报), 2020, 41(10): 2211–2215.
|
| [14] |
Xu Kun-lun(徐坤仑), Cao Zu-bin(曹祖宾), Qiao Hai-yan(乔海燕), et al. CuI/2, 2'-bipyridine/2, 2, 6, 6-tetramethylpiperidinooxy catalytic oxidation process of alcohol to nitrile(CuI/2, 2'-联吡啶/2, 2, 6, 6-四甲基哌啶氧化物催化氧化醇生成腈的工艺)[J]. Chin J Appl Chem(应用化学), 2018, 35(11): 1335–1341.
DOI:10.11944/j.issn.1000-0518.2018.11.170446 |
| [15] |
Huo Wen-ge(霍文阁), Yang Mei(杨美), Zhai Lin(翟琳), et al. Synthesis of β-cyclodextrin supported 2, 2, 6, 6-tetramethylpiperidine-1-oxyl and its catalytic performance on the oxidation of alcohols with molecular oxygen as oxidant(β-环糊精负载四甲基哌啶氮氧化物的合成及其在分子氧氧化醇反应中的催化性能)[J]. J Mol Catal (China)(分子催化), 2016, 30(4): 307–316.
|
| [16] |
Semmelhack M F, Schmid C R, Cortes D A, et al. Oxi-dation of alcohols to aldehydes with oxygen and cupric ion, mediated by nitrosonium ion[J]. J Am Chem Soc, 1984, 106(11): 3374–3376.
DOI:10.1021/ja00323a064 |
| [17] |
Bolm C, Legros J, Le Paih J, et al. Iron-catalyzed reactions in organic synthesis[J]. Chem Rev, 2004, 104(12): 6217–6254.
DOI:10.1021/cr040664h |
| [18] |
Enthaler S, Junge K, Beller M. Sustainable metal catalysis with iron: From rust to a rising star?[J]. Angew Chem Int Ed, 2008, 47(18): 3317–3321.
DOI:10.1002/anie.200800012 |
| [19] |
Correa A, Mancheno O G, Bolm C. Iron-catalysed carbon-heteroatom and heteroatom-heteroatom bond forming processes[J]. Chem Soc Rev, 2008, 37(6): 1108–1117.
DOI:10.1039/b801794h |
| [20] |
Sherry B D, Fürstner A. The promise and challenge of iron-catalyzed cross coupling[J]. Acc Chem Res, 2008, 41(11): 1500–1511.
DOI:10.1021/ar800039x |
| [21] |
Wang L, Li J, Lv Y, et al. Selective aerobic oxidation of alcohols catalyzed by iron chloride hexahydrate/TEMPO in the presence of silica gel[J]. Appl Org Chem, 2012, 26(1): 37–43.
DOI:10.1002/aoc.1862 |
| [22] |
Kashiwagi Y, Ikezoe H, Ono T. Oxidation of alcohols with nitroxyl radical resins under two-phase conditions[J]. Synlett, 2006, 2006(1): 69–72.
|
| [23] |
Lagerblom K, Wrigstedt P, Keskiv-li J, et al. Iron-catalysed selective aerobic oxidation of alcohols to carbonyl and carboxylic compounds[J]. ChemPlusChem, 2016, 81(11): 1160–1165.
DOI:10.1002/cplu.201600240 |
| [24] |
Martín S E, Suárez D F. Catalytic aerobic oxidation of al-cohols by Fe (NO3)3-FeBr3[J]. Tetrahedron Lett, 2002, 43(25): 4475–4479.
DOI:10.1016/S0040-4039(02)00829-8 |
| [25] |
Wang N, Liu R, Chen J, et al. NaNO2-activated, iron-TEMPO catalyst system for aerobic alcohol oxidation under mild conditions[J]. Chem Commun, 2005, 42(42): 5322–5324.
|
| [26] |
Yin W, Chu C, Lu Q, et al. Iron chloride/4‐acetamido‐TEMPO/sodium nitrite‐catalyzed aerobic oxidation of primary alcohols to the aldehydes[J]. Adv Synth Catal, 2010, 352(1): 113–118.
DOI:10.1002/adsc.200900662 |
| [27] |
Cohen S M. Modifying MOFs: New chemistry, new materials[J]. Chem Sci, 2010, 1(1): 32–36.
DOI:10.1039/c0sc00127a |
| [28] |
Wang Li-ping(王丽苹), Wang Gong-ying(王公应). Prog-ress in metal-organic frameworks based on the carboxyl ligands as the catalyst(羧基配体金属有机骨架材料作为催化剂的研究进展)[J]. J Mol Catal(China)(分子催化), 2015, 29(3): 275–287.
|
| [29] |
Huang Gang(黄刚), Chen Yu-zhen(陈玉贞), Jiang Hai-long(江海龙). Metal-organic frameworks for catalysis(金属有机骨架材料在催化中的应用)[J]. Acta Chem Sin(化学学报), 2016, 74(2): 113–129.
|
| [30] |
Čendak T, Žunkovič E, Godec T U, et al. Indomethacin embedded into MIL-101 frameworks: A solid-state NMR study[J]. J Phys Chem C, 2014, 118(12): 6140–6150.
DOI:10.1021/jp412566p |
| [31] |
Sun J, Yu G, Huo Q, et al. Epoxidation of styrene over Fe (Cr)-MIL-101 metal-organic frameworks[J]. RSC Adv, 2014, 4(72): 38048–38054.
DOI:10.1039/C4RA05402D |
| [32] |
Barbosa A D S, Julião D, Fernandes D M, et al. Catalytic performance and electrochemical behaviour of Metal-organic frameworks: MIL-101 (Fe) versus NH2-MIL-101 (Fe)[J]. Polyhedron, 2017, 127: 464–470.
DOI:10.1016/j.poly.2016.10.032 |
| [33] |
Zhao M, Yuan K, Wang Y, et al. Metal-organic fram-eworks as selectivity regulators for hydrogenation reactions[J]. Nature, 2016, 539(7627): 76–80.
DOI:10.1038/nature19763 |
| [34] |
Wang D, Li Z. Bi-functional NH2-MIL-101 (Fe) for one-pot tandem photo-oxidation/Knoevenagel condensation between aromatic alcohols and active methylene compounds[J]. Catal Sci Technol, 2015, 5(3): 1623–1628.
DOI:10.1039/C4CY01464B |
| [35] |
Dhakshinamoorthy A, Alvaro M, García H. Aerobic oxidation of benzylic alcohols catalyzed by metal- organic frameworks assisted by TEMPO[J]. ACS Catal, 2011, 1(1): 48–53.
DOI:10.1021/cs1000703 |
| [36] |
Kim S, Lee H E, Suh J M, et al. Sequential connection of mutually exclusive catalytic reactions by a method controlling the presence of an MOF catalyst: One-Pot oxidation of alcohols to carboxylic acids[J]. Inorg Chem, 2020, 59(23): 17573–17582.
DOI:10.1021/acs.inorgchem.0c02809 |
| [37] |
Shu X, Yu Y, Jiang Y, et al. Direct synthesis of Fe (Ⅲ) immobilized Zr-based metal-organic framework for aerobic oxidation reaction[J]. Appl Org Chem, 2017, 31(12): e3862.
DOI:10.1002/aoc.3862 |
| [38] |
Dhakshinamoorthy A, Asiri A M, Garcia H. Tuneable nature of metal organic frameworks as heterogeneous solid catalysts for alcohol oxidation[J]. Chem Commun, 2017, 53(79): 10851–10869.
DOI:10.1039/C7CC05927B |
| [39] |
Kim B R, Oh J S, Kim J, et al. Robust aerobic alcohol oxidation catalyst derived from metal-organic frameworks[J]. Catal Lett, 2016, 146(4): 734–743.
DOI:10.1007/s10562-016-1700-2 |
| [40] |
Dong Z, Sun Y, Chu J, et al. Multivariate metal-organic frameworks for dialing-in the binding and programming the release of drug molecules[J]. J Am Chem Soc, 2017, 139(40): 14209–14216.
DOI:10.1021/jacs.7b07392 |
| [41] |
Rafiee M, Miles K C, Stahl S S. Electrocatalytic alcohol oxidation with TEMPO and bicyclic nitroxyl derivatives: Driving force trumps steric effects[J]. J Am Chem Soc, 2015, 137(46): 14751–14757.
DOI:10.1021/jacs.5b09672 |
| [42] |
Lauber M B, Stahl S S. Efficient aerobic oxidation of secondary alcohols at ambient temperature with an ABNO/NOx catalyst system[J]. ACS Catal, 2013, 3(11): 2612–2616.
DOI:10.1021/cs400746m |
 2021, Vol. 35
2021, Vol. 35