手性是自然界的本质属性之一, 作为生命活动重要物质基础的生物大分子几乎全是手性的. 手性药物的两个对映体在动物体内的生理活性、药代及毒副作用等方面通常差异显著, 因此手性药物的拆分研究备受关注[1−3]. 3-氯-1-苯基丙醇是氟西汀、尼索西汀、托莫西汀等抗抑郁类专用特效药的重要中间体, 其R型对映体的药效是S型对映体药效的9倍, 因此(R,S)-3-氯-1-苯基丙醇的拆分研究具有重要意义. 手性化合物的传统拆分方法是化学催化法, 但存在拆分剂昂贵、反应条件苛刻(高温高压与强酸强碱)、光学纯度低等缺点, 难以满足实际工业生产的要求. 与传统的化学法相比, 酶催化法因具有选择性强、反应条件温和、环境友好等优点而深受青睐[4−6].
目前, 酶催化大多是在水相和有机介质中进行, 但对于大多数有机化合物来说, 水并不是一种适宜的溶剂. 因为许多底物在水相介质中难溶或不溶, 且由于水的存在, 往往会伴随水解、消旋、聚合和分解等副反应的发生; 而有机介质挥发性较强、易残留, 极易污染环境. 因此, 开发高效率、高选择性且更为绿色的反应体系, 是酶催化技术在工业化应用中亟待攻克的技术难题. 我们的研究结果表明, 在无溶剂体系中, 采用介孔分子筛SBA-15固定化荧光假单胞菌脂肪酶(P. fluorescens lipase, PFL)拆分(R,S)-3-氯-1-苯基丙醇(图1), 不仅催化效率较高、对映体选择性强, 而且成本低廉、环境友好, 相关研究结果对于(R,S)-3-氯-1-苯基丙醇酶促拆分技术的工业化应用具有重要意义.
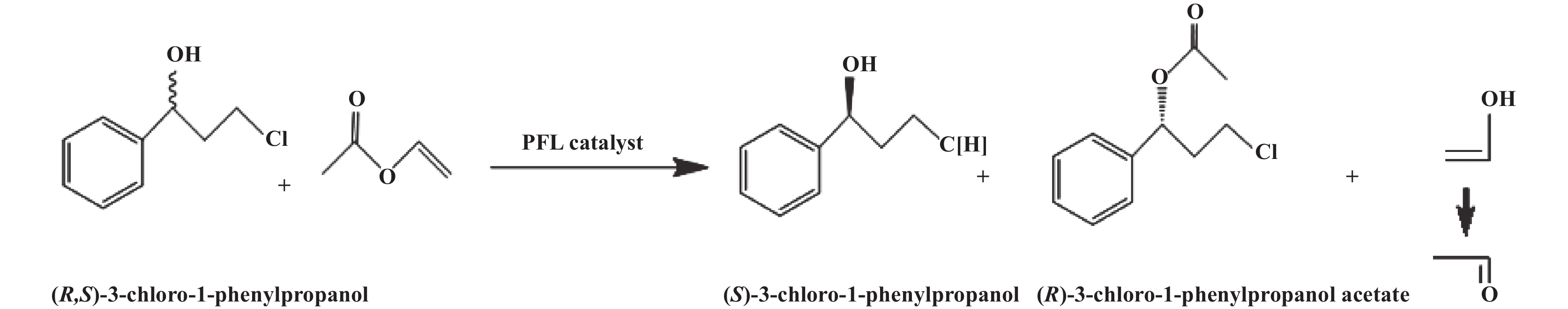
|
图 1 介孔分子筛SBA-15固定化PFL拆分(R,S)-3-氯-1-苯基丙醇 Fig.1 Resolution of (R,S)-3-chloro-1-phenylpropanol by SBA-15 molecular sieve immobilized PFL |
PFL为本实验室发酵生产; (R)-3-氯-1-苯基丙醇、(S)-3-氯-1-苯基丙醇(阿拉丁生化试剂有限公司, 光学纯); 乙酸乙烯酯(梯希爱化成工业发展有限公司, 分析纯); 介孔分子筛SBA-15(翰隆达科技发展有限公司); HPLC(美国syltech公司, Model 500G), 色谱柱: CHIRALCEL OD-H(日本Daicel公司, 250 mm×4.6 mm, 5 µm); 其他试剂均为国产分析纯, 所有液体试剂使用前用0.3 nm分子筛脱水.
1.2 PFL的固定化在100 mL三角瓶中, 将0.4 g PFL溶解于20 mL pH=7.0磷酸盐缓冲液, 加入2 g干燥载体, 150 r·min−1、15 ℃水浴振摇6 h, 过滤后以pH=7.0磷酸盐缓冲液洗涤3次, 冷冻干燥备用.
1.3 PFL催化拆分在自制恒温间歇式反应器中加入4.5 mL (R,S)-3-氯-1-苯基丙醇、5.5 mL乙酸乙烯酯, 再按300 U/mL (R,S) -3-氯-1-苯基丙醇的比例加入固定化PFL, 于60 ℃下搅拌反应28 h.
1.4 水合盐控制体系水活度根据参考文献[7]的方法, 在反应前无溶剂体系中加入已知水活度的不同水合盐对, 于30 ℃下预平衡24 h.
1.5 PFL活力测定我们在参考文献[8]的基础上稍加改进. 以PFL在35 ℃、pH=7.0条件下1 min时间内水解橄榄油释放1 µmol游离脂肪酸需要的酶量定义为1个酶活力单位(U).
1.6 反应转化率、对映体过量值及选择率测定在参考文献[9]基础上加以改进, 通过HPLC定量测定. 色谱柱: CHIRALCEL OD-H(250 mm×4.6 mm, 5 µm); 色谱条件: 流动相, 异丙醇∶正己烷=5∶95; 流速, 1.0 mL·min−1; 检测波长, 215 nm; 柱温, 28 ℃; 进样量, 20 µL. 3-氯-1-苯基丙醇及3-氯-1-苯基丙醇乙酸酯的对映体过量值(ee)、拆分转化率(c)和对映体选择率(E)按如下公式计算[10−11]:
| $ ee({\text{%}} ) = \frac{{S - R}}{{S + R}} \times 100 $ |
| $ c({\text{%}} ) = \frac{{e{e_S}}}{{e{e_S} + e{e_P}}} \times 100 $ |
| $ E = \frac{{\ln [(1 - c)(1 - e{e_S})]}}{{\ln [(1 - c)(1 + e{e_S})]}} = \frac{{\ln [1 - c(1 + e{e_P})]}}{{\ln [1 - c(1 - e{e_P})]}} $ |
式中, S、R代表S-、R-对映体浓度, ees、 eep为(S) -3-氯-1-苯基丙醇、(R) -3-氯-1-苯基丙醇乙酸酯的对映体过量值, E为酶促拆分反应选择率.
2 结果与讨论 2.1 SBA-15固定化对PFL催化性能的影响采用不同载体固定化PFL, 在无溶剂体系中利用固定化PFL拆分(R,S)-3氯-1-苯基丙醇, 结果如表1所示. 由表可知, 分子筛SBA-15固定化PFL催化的拆分反应转化率可达49.87%, 而产物对映体过量值eep也比较理想(98.73%), 对映体选择率(E)则高达742.56, 远高于文献报道值[12−14].
| 表 1 固定化载体对PFL催化(R,S)-3-氯-1-苯基丙醇的影响 Table 1 Effect of carrier on the resolution of (R,S) - 3-chloro-1-phenylpropanol by PFL in solvent-free system system |
分子筛SBA-15是一种人工合成的具有排列整齐、孔径均匀的孔穴的多孔材料, 其孔径通常在1~15 nm之间. 分子筛SBA-15的孔穴大小与酶分子相近, 且性质极其稳定, 孔穴内所持有的水分在为酶分子提供使其发挥正常功能微环境的同时, 还可以防止酶分子脱落[15]. 这些特点使其在无溶剂体系中应用时具有明显优势, 因此其转化率(c)和产物对映体过量值(eep)均明显高于其它载体.
2.2 酰基供体类型对酶促拆分反应的影响PFL酶促拆分(R,S)-3氯-1-苯基丙醇的机理, 首先是酶与酰基供体形成酶-酰基复合体, 然后酶-酰基复合体供体对(R,S)-3氯-1-苯基丙醇进行立体选择性结合, 因此酰基供体类型势必会对酶促拆分反应产生影响(表2). 结果表明, 以乙酸乙烯酯作为酰基供体时的拆分效果最好, 转化率达到49%以上, 而其它酰基供体的转化率则低得多(<35%), 甚至完全不发生反应. 主要原因在于, 采用乙酸乙烯酯作为酰基供体时, 反应生成的烯醇式结构极不稳定, 会很快转化为乙醛, 造成不可逆而利于反应向右移动[16].
| 表 2 酰基供体类型对介孔分子筛SBA-15固定化PFL拆分(R,S)-3-氯-1-苯基丙醇的影响 Table 2 Effect of acyl donor on the resolution of (R,S) - 3-chloro-1-phenylpropanol by PFL immobilized on mesoporous molecular sieve SBA-15 in solvent-free system system |
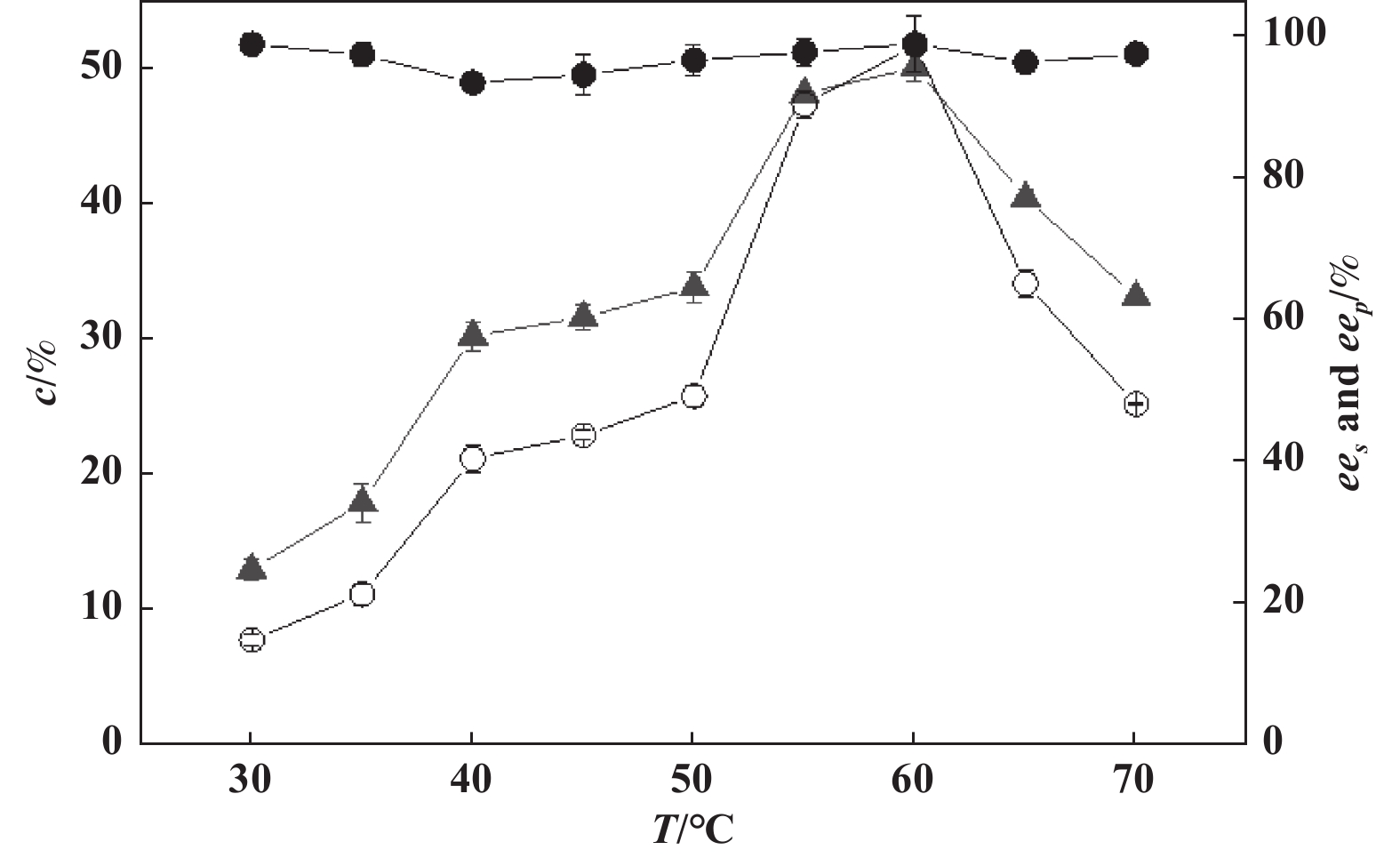
采用介孔分子筛SBA-15固定化PFL在不同温度条件下(30~70 ℃)对(R,S)-3氯-1-苯基丙醇进行拆分, 考察了温度对拆分反应的影响, 结果见图2. 由图可知, 当温度低于60 ℃时, 反应转化率随温度的升高而逐渐增加; 当温度达到60 ℃时, 转化率可达49%以上, 而此时eep高达98%以上, ees也可达95%以上, 说明在此条件下, 酶促拆分反应的进行较为完全, 而且立体选择性较好; 但当温度超过60 ℃时, 转化率随着温度的升高而迅速降低.
|
图 2 温度对介孔分子筛SBA-15固定化PFL拆分(R,S)-3-氯-1-苯基丙醇的影响 Fig.2 Effect of temperature on the resolution of (R,S)-3-chloro-1-phenylpropanol by PFL immobilized on mesoporous molecular sieve SBA-15 in solvent-free system system (○ ees; ● eep; ▲ Conversion) |
反应温度对固定化酶的催化表现有重要影响, 一般因酶源和固定化方法而异[17−19]. 一般认为, 温度对固定化酶的影响主要包括3个方面: 传质效应、热力学效应以及失活效应. 当温度较低时, 固定化载体产生的传质障碍为主要不利因素, 导致拆分转化率较低; 当温度逐渐升高时, 由于分子运动加剧, 底物传递及产物扩散逐渐变得更为容易, 至60 ℃左右时基本可抵消这种由传质障碍带来的不利影响; 但当温度过高时, 酶分子变性失活加剧, 从而导致其催化性能也随之下降.
2.4 “记忆”pH对酶促拆分反应的影响非水体系中固定化酶的活性与pH的关系同固定化前游离酶活力与pH的关系相似, 这种能够记忆最后保存环境水溶液pH的现象, 称为“pH记忆”(pH memory), 这种pH “记忆”性已为诸多学者所证实[20]. 考察了“记忆”pH对无溶剂体系中介孔分子筛SBA-15固定化PFL拆分(R,S)-3氯-1-苯基丙醇的影响, 结果见图3. 由图可见, 拆分反应的最适“记忆”pH为7.0, 此时PFL拆分(R,S)-3氯-1-苯基丙醇反应的转化率和ees均达最高值, 且eep一直保持在98%左右; 当pH高于或低于7.0时, 都不利于酶促反应的进行.

|
图 3 “记忆”pH对介孔分子筛SBA-15固定化PFL拆分(R,S)-3-氯-1-苯基丙醇的影响 Fig.3 Effect of "memory" pH on the resolution of (R,S) - 3-chloro-1-phenylpropanol by PFL immobilized on mesoporous molecular sieve SBA-15 in solvent-free system system (○ ees; ● eep; ▲ Conversion) |
一般认为, pH影响酶促反应的原因主要包括3个方面: 1) pH影响酶分子活性部位上相关基团的解离; 2) pH影响底物分子的解离状态; 3) 过酸、过碱会导致酶蛋白的正确构象发生改变或变性失活. 我们通过研究发现, 在过酸与过碱条件下, 介孔分子筛SBA-15固定化PFL的催化性能都明显下降, 推测与酶蛋白分子的变性失活有关.
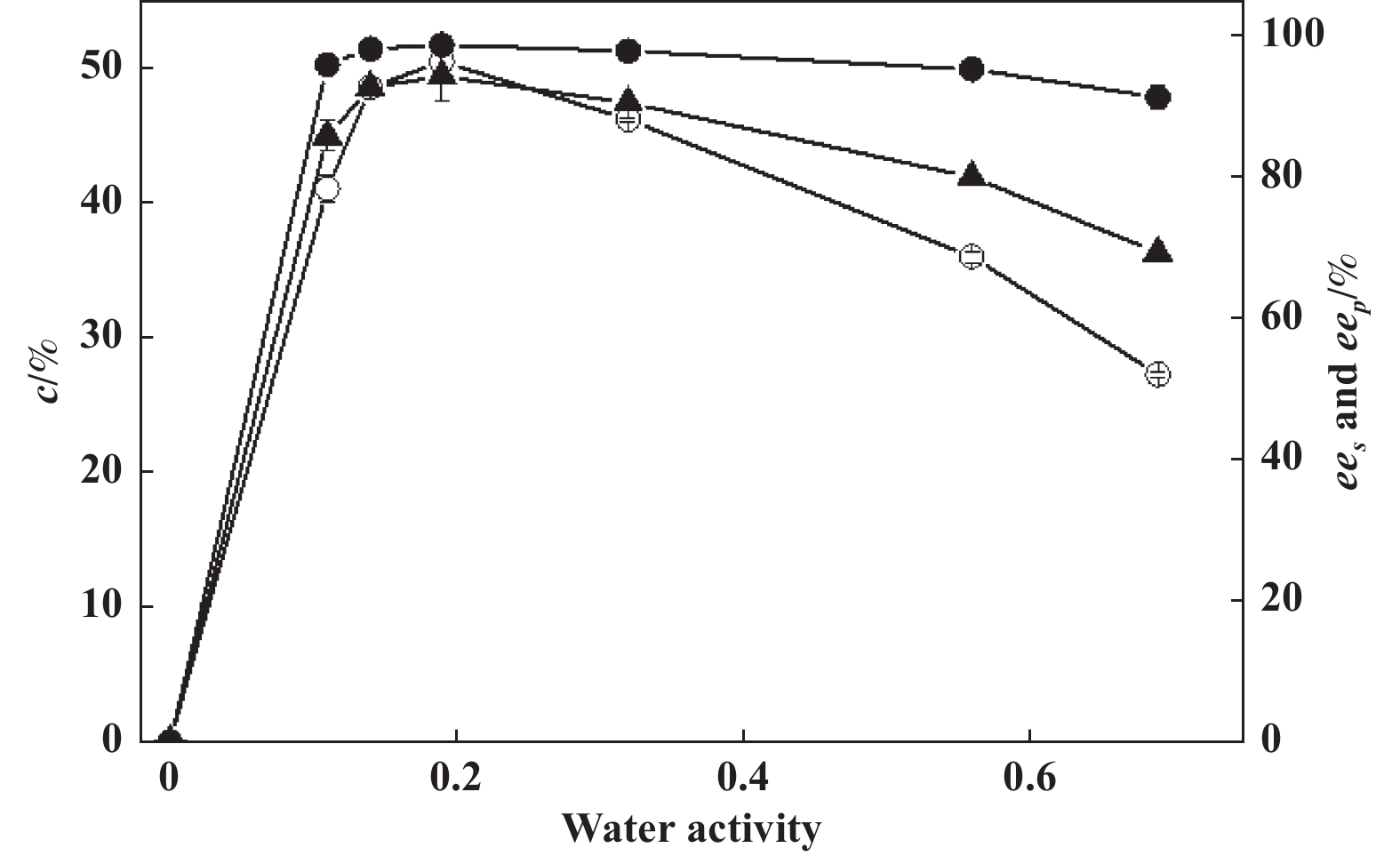
2.5 水活度对酶促拆分反应的影响在非水体系中, 酶能否具有催化活性和选择性与吸附于酶分子周围的水化层, 即必需与水密切相关[21−24]. 因此, 考察了水活度对介孔分子筛SBA-15固定化PFL拆分(R,S)-3氯-1-苯基丙醇的影响(图4). 由图可见, 当水活度较低时, 随着体系水活度的升高, 拆分反应转化率和对映体过量值都随之增加; 当水活度增至0.19时, 反应转化率与对映体过量值都达到最高值; 而当水活度高于0.19时, 转化率与对映体过量值均开始降低.
|
图 4 水活度对无溶剂体系中 (R,S)- 3-氯-1-苯基丙醇拆分反应的影响 Fig.4 Effect of water activity on the resolution of (R,S) - 3-chloro-1-phenylpropanol by PFL immobilized on mesoporous molecular sieve SBA-15 in solvent-free system system (○ ees; ● eep; ▲ Conversion) |
通常认为, 非水相中酶分子构象的“刚柔性”与反应体系的水活度大小密切相关[25]. 当无溶剂体系中水活度低于最适水活度时, 酶分子的构象会由于“刚性”过强导致酶与底物的诱导契合过程受阻而失活; 而当体系水活度过高时, 酶分子的构象会由于“柔性”过强而在疏水条件下发生非特异性聚集而失活. 只有处于最适体系水活度时, 酶分子构象才会达到动力学刚柔平衡而呈现出最大活性和最佳对映体选择性.
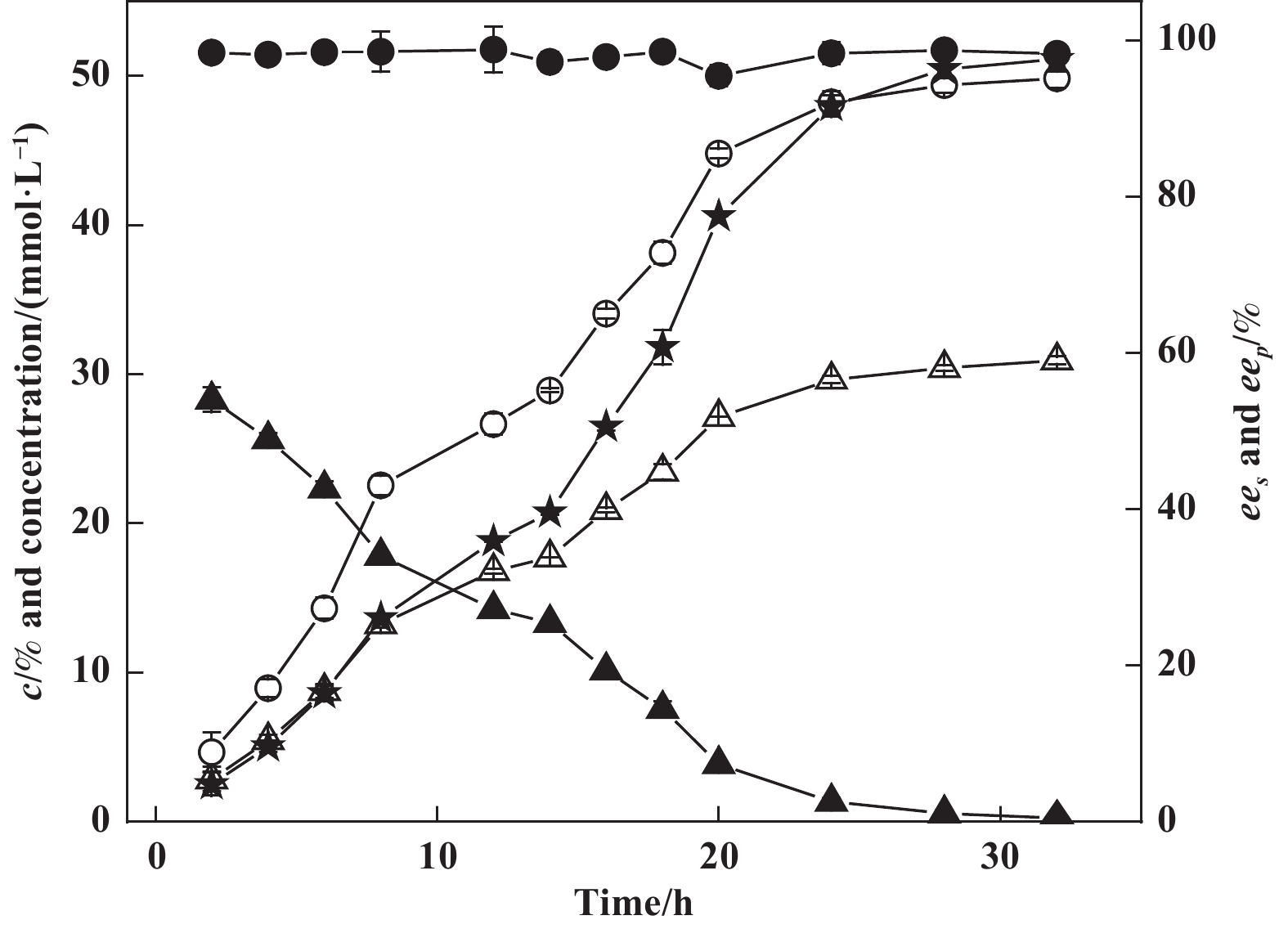
2.6 SBA-15固定化PFL拆分(R,S)- 3-氯-1-苯基丙醇在优化条件下, 介孔分子筛SBA-15固定化PFL拆分(R,S)-3氯-1-苯基丙醇的进程曲线见图5. 由图可知, 在拆分反应的初始阶段, 转化率随着反应的进行而持续升高, 在28 h左右时达到49.87%, 接近理论转化率最高值; 在整个反应过程中, 产物对映体过量值均稳定于较高水平, 只有小幅波动; 随着反应的进行, 底物对映体过量值逐渐升高, 直至平衡时可达到95%以上. 试验结果表明, 无溶剂体系介孔分子筛SBA-15固定化PFL生物催化拆分(R,S)-3氯-1-苯基丙醇, 具有较强的催化活性和对映体选择性, 显示了良好的应用前景.
|
图 5 无溶剂体系中(R,S)-3-氯-1-苯基丙醇拆分反应进程 Fig.5 Time course of the resolution of (R,S) -3-chloro-1-phenylpropanol in solvent-free system (○ ees; ● eep; ★ Conversion; △ Conc. of (R)-3-chloro-1-phenylpropanol acetate; ▲ Conc. of (R)-3-chloro-1-phenylpropanol) |
无溶剂体系是近年发展起来的一种新的反应体系, 无需添加任何溶剂作为反应介质, 不仅可以降低生产成本, 还有利于保护环境. 在无溶剂条件下, 底物浓度可达最大而有利于提升反应速率, 而且还可克服溶剂对催化过程的不良影响. 酶催化具有选择性强、反应温和、经济、环保等优点, 以酶促拆分替代传统化学拆分符合我国的产业政策, 也是我国经济可持续发展的正确方向. 在无溶剂体系中进行的酶促催化是符合现代工业需求的一种新的酶催化方法, 具有底物浓度高、反应速率快、产物易分离纯化、环境友好等优点, 具有良好的应推广价值. 我们发现, 在无溶剂体系中, 利用介孔分子筛SBA-15固定化PFL酶促拆分(R,S)-3氯-1-苯基丙醇, 在乙酸乙烯酯作为酰基供体、水活度为0.19、温度为60 ℃、“记忆”pH为7.0的条件下反应28 h, 转化率可达49.87%, eep高达98.73%, 显示了良好的应用前景, 相关研究结果对于推动(R,S)-3-氯-1-苯基丙醇酶促拆分技术的工业化应用具有重要意义.
| [1] |
a. de Sousa Fonseca T, de Oliveira U M, de Oliveira M D, et al. Immobilization of amano lipase AK from pseudomonas fuorescens on diferent types of chitosancontaining supports: Use in the kinetic resolution of racindanol[J]. Bioproc Biosyst Eng, 2021, 44: 785−792.b. Chen Lin-lin(陈林林), Zhang Jia-xin(张佳欣), Li Wei(李 伟), et al. Preparation and catalytic properties of inorganic hybrid lipase(无机杂化脂肪酶的制备及其催化性能研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(3): 235−244.c. Ning Yong-yue(宁永月), Li Gang-yong(李刚勇), Zheng Xu-chao(郑旭超), et al. Research progress of on body enzyme biofuel cell(在体酶生物燃料电池的研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(4): 365−374
|
| [2] |
Insight into immobilization efficiency of Lipase enzyme as a biocatalyst on the graphene oxide for adsorption of Azo dyes from industrial wastewater effluent[J]. J Mol Liq, 2022, 354: 118849.
DOI:10.1016/j.molliq.2022.118849 |
| [3] |
Enzymatic synthesis of chiral intermediates for omapatrilat, an antihypertensive drug[J]. Biomol Eng, 2001, 17(6): 167–182.
DOI:10.1016/S1389-0344(01)00068-5 |
| [4] |
De novo construction of multi-enzyme system for one-pot deracemization of (R, S)-1-phenyl-1, 2-ethanediol by stereoinversion of (S)- enantiomer to the corresponding counterpart
[J]. J Mol Catal B:Enzym, 2016, 129: 21–28.
DOI:10.1016/j.molcatb.2016.04.003 |
| [5] |
One-pot preparation of d-amino acids through biocatalytic deracemization using alanine dehydrogenase and ω-transaminase
[J]. Catal Lett, 2018, 148(12): 3678–3684.
DOI:10.1007/s10562-018-2565-3 |
| [6] |
A biocatalytic redox cascade approach for one-pot deracemization of carboxylsubstituted tetrahydroisoquinolines by stereoinversion[J]. Green Chem, 2019, 21(20): 5579–5585.
DOI:10.1039/C9GC02795E |
| [7] |
Selection of salt hydrate pairs for use in water control in enzyme catalysis in organic solvents[J]. Biotechnol Bioeng, 1997, 55(2): 367–374.
DOI:10.1002/(SICI)1097-0290(19970720)55:2<367::AID-BIT14>3.0.CO;2-E |
| [8] |
Purification and prop erties of extracellular lipase from Streptomyces rimosus
[J]. Enzyme Microb Technol, 1999, 25(6): 522–529.
DOI:10.1016/S0141-0229(99)00077-0 |
| [9] |
Chromatographic separation of phenylpropanol enantiomers on a quinidine carbamate-type chiral stationary phase[J]. J Chromatogr A, 2005, 1091(1/2): 11–20.
|
| [10] |
Immobilization of pseudomonas fluorescens lipase on chitosan crosslinked with polyaldehyde starch for kinetic resolution of sec-alcohols[J]. Process Biochem, 2022, 122(2): 238–247.
|
| [11] |
Effect of lipase immobilization on the resolution of (R,S)-2-octanol in nonaqueous media using modified ultrastable-Y molecular sieve as support
[J]. App Biochem Biotech, 2006, 134(1): 39–50.
DOI:10.1385/ABAB:134:1:39 |
| [12] |
Mechanoenzymology in the kinetic resolution of β-Blockers: Propranolol as a case study
[J]. ACS Org Inorg, 2022, 2(4): 343–350.
DOI:10.1021/acsorginorgau.1c00049 |
| [13] |
Enzyme- and Ruthenium-Catalyzed dynamic kinetic resolution of functionalized cyclic allylic alcohols[J]. J Org Chem, 2013, 78(23): 12114–12120.
DOI:10.1021/jo402086z |
| [14] |
An efficient route to enantiomerically pure antidepressants: Tomoxetine, nisoxetine and fluoxetine[J]. Tetrahedron Asymmetry, 1992, 3(4): 525–528.
DOI:10.1016/S0957-4166(00)80257-8 |
| [15] |
Lipase immobilized in ordered mesoporous silica: A powerful biocatalyst for ultrafast kinetic resolution of racemic secondary alcohols[J]. Process Biochem, 2017, 53: 102–108.
DOI:10.1016/j.procbio.2016.12.005 |
| [16] |
Enzymatic resolution of a chiral chlorohydrin precursor for (R)-α-lipoic acid synthesis via lipase catalyzed enantioselective transacylation with vinyl acetate
[J]. J Mol Catal B:Enzym, 2014, 99: 102–107.
DOI:10.1016/j.molcatb.2013.11.005 |
| [17] |
Exploring the structural and catalytic features of lipase enzymes immobilized on g-C3N4: A novel platform for biocatalytic and photocatalytic reactions
[J]. J Mol Liq, 2021, 337: 116612.
DOI:10.1016/j.molliq.2021.116612 |
| [18] |
Highly effective enzymes immobilization on ceramics: Requirements for supports and enzymes[J]. Sci Total Environ, 2021, 801: 149647.
DOI:10.1016/j.scitotenv.2021.149647 |
| [19] |
Immobilization of Bacillus amyloliquefaciens protease “Neutrase” as hybrid enzyme inorganic nanoflower particles: A new biocatalyst for aldol-type and multicomponent reactions[J]. Int J Biol Macromol, 2023, 230: 123140.
DOI:10.1016/j.ijbiomac.2023.123140 |
| [20] |
Properties of epoxide hydrolase from Aspergillus niger for the hydrolytic kinetic resolution of epoxides in pure organic media
[J]. Enzyme Microb Tech, 2006, 39(2): 318–324.
DOI:10.1016/j.enzmictec.2005.11.002 |
| [21] |
Effect of solvent and initial water content on (R,S)-1-phenylethanol resolution
[J]. Enzyme Microb Tech, 2006, 38(3/4): 551–556.
|
| [22] |
Wheat germ lipase catalyzed kinetic resolution of secondary alcohols in non-aqueous media[J]. Biotechnol Lett, 2009, 31(1): 83–87.
DOI:10.1007/s10529-008-9823-1 |
| [23] |
Kinetic and thermodynamic investigation of Lipase-Catalyzed hydrolysis of (R, S)-3-Phenylbutyl azolides
[J]. Ind Eng Chem Res, 2012, 51(9): 3580–3586.
DOI:10.1021/ie200574a |
| [24] |
Biocatalytic kinetic resolution of rac-1-pHenylethanol and rac-2-pentanol in hexane medium: ACYL donor and water content effects[J]. Can J Chem Eng, 2010, 88(3): 441–446.
|
| [25] |
Enzymatic resolution of (R,S)-2-octanol by Ultrastable-Y molecular sieve immobilized-lipase in microaqueous media
[J]. Chem J Chin Univ, 2007, 28(12): 2307–2310.
|
 2023, Vol. 37
2023, Vol. 37


